Total Pengunjung Blog
Buku & Sastra Made Gue
All about CPOB
- download CPOB 2006 dan PCPOB 2009
- "catatan" dokumentasi berdasar CPOB
- Pets control berdasar CPOB 2006 serta implementasinya
- inspeksi diri dan audit berdasar CPOB 2006
- dasar - dasar kalibrasi alat
- Apa itu retain sampel BB dan produk jadi serta ongoing stabiliti?
- water treatment for pharmaceutical use
- Berbagai bentuk perawatan mesin industri farmasi dan pengertian downtime
- Apa itu retain sampel BB dan produk jadi serta ongoing stabiliti?
- Alat pengatur tekanan udara (magnehelic)
- instalasi pengolahan air limbah with aerob system
- Master requirment planning
- master production scheduling
- Cleaning validation
- 10 prinsip CPOB
- Validasi proses
- HVAC (Heating ventilation air conditioning
- water treatment in pharmaceutical industrion
- tata ruang industri farmasi beta laktam production & non betalaktam
- stability studi?
Penelitian & Kuliah
- Tips hemat dalam penelitian
- kristalisasi sederhana
- pelarut murni, perlukah untuk penelitian ?
- Cara memurnikan sampel yang jumlahnya sedikit ?
- Mendaur ulang silika bekas kromatografi kolom
- cara memilih hewan uji untuk penelitian
- Agar tak menjadi plagiat
- cara memilih solven untuk fase gerak KLT
- Pola data statistika yang sering di jumpai difarmasi
- tips mencari referensi ilmiah untuk mengerjakan tugas akhir
- Tutorial ms.word, mumudahkan menulis skirpsi (membuat daftar isi, page number, daftar pustaka
- Informasi seputar Beasiswa unggulan dan tips agar diterima
- Berbagai macam judul buku farmasi untuk referensi
- Cara download gratis jurnal berbayar maupun ebook
Arsip Blog
- 2017 (5)
- 2016 (3)
- 2015 (4)
- 2014 (8)
- 2013 (17)
- 2012 (71)
-
2011
(151)
- Desember(9)
- November(6)
- Oktober(17)
-
September(36)
- Penemuan Dan Pengembangan Obat Berbasis Farmakolog...
- Target Aksi Obat dan Contohnya…(Farmakologi moleku...
- Download CPOB 2006 & Petunjuk CPOB 2009 beserta La...
- Tak mau aku meminangmu hanya dengan basmallah….!(m...
- Preparation Sampel (Kuliah II analisis Farmasi Pro...
- dari DNA hingga Analisis Sidik Jari.(Biomol pertem...
- Kenapa Kadar glukosa dalam darah bisa merangsang p...
- Modifikasi Kimia dan Evaluasi Biologi Senyawa-seny...
- DOKUMENTASI
- Pets Control (CPOB 2006 & Petunjuk serta implement...
- INSPEKSI DIRI DAN AUDIT (CPOB 2006 dan Petunjuk CP...
- KALIBRASI ALAT
- RETAIN SAMPEL BAHAN BAKU DAN PRODUK JADI INDUSTRI ...
- Water for Pharmaceutical Use / Air untuk Industri ...
- Berbagai Bentuk Perawatan (Maintenance) Mesin Indu...
- NUCLEAR MAGNETIC RESONANCE (NMR) SPECTROSCOPY = SP...
- BAB III. BANGUNAN DAN FASILITAS
- BAB IV. PERALATAN
- BAB V. SANITASI DAN HIGIENE
- BAB VI. PRODUKSI
- BAB VII. PENGAWASAN MUTU
- BAB VIII. INSPEKSI DIRI DAN AUDIT MUTU
- BAB 9. PENANGANAN KELUHAN TERHADAP PRODUK, PENARIK...
- BAB 11. PEMBUATAN DAN ANALISIS BERDASARKAN KONTRAK
- BAB 12. KUALIFIKASI DAN VALIDASI
- BAB II. PERSONALIA
- BAB 1. MANAGEMENT MUTU
- Kenapa Orang Diabetes itu lapar terus??Padahal ser...
- Cara Pembuatan Proposal Penelitian Part 1 (Metode ...
- NUCLEAR MAGNETIC RESONANCE (NMR) SPECTROSCOPY = SP...
- Struktur & Fungsi DNA, RNA, dan Protein (Prof. Sud...
- PANDUAN PENULISAN PROGRAM KREATIVITAS MAHASISWA (...
- Hasil Rapat Halal Bihalal Online KOPI Tanggal 9 Se...
- APA ITU KOPI??
- ALAT PENGATUR TEKANAN UDARA (Magnehelic®)/ Differe...
- IPAL (Instalasi Pengolahan Air Limbah) With Aerob ...
- Agustus(5)
- Juli(2)
- Juni(8)
- Mei(14)
- April(19)
- Maret(16)
- Februari(9)
- Januari(10)
- 2010 (70)
- 2009 (43)
- 2008 (4)
Daftar ISI
- DETERJEN (9)
- KOPI (24)
- PENELITIAN (16)
- PERISAI DIRI (12)
- PRIBADIKU (38)
- Sastra (98)
- Tips (24)
- computer and software (5)
- creative (18)
- dari blog friensdster (32)
- kuliah and buku (31)
- my BOOK (5)
- pascasarjana (43)
- profesi (45)
Pengikut
Popular Posts
-
Dear temen…kali ini andy lagi di tugasi oleh dosen untuk menulis 50 bahasa latin, gara =gara pretest andy g memenuhi kualifikasi.hehehe…...
-
Bagan alur ada di bawah….andy tampilkan di awal tulisan, agar nanti setelah membaca bagan bisa lebih paham.
-
PEMBALUT Pembalut tipis/plester of paris, sebelum pasien diberi pembalut gips, maka bagian tubuh tersebut diberi lapisan kapas gips yan...
-
Nama panjangku, Andy Eko wibowo, lahir pada tanggal 2 Juni 1988. Ayah bernama Dwi Yanto, dan Ibu bernama Retno Asih suminiati. Mempunyai dua...
-
Dear teman…..dear kawan-kawan sejawat farmasi dan kawan-kawan tercinta…meninjau kebutuhan teman-teman profesi terutama untuk yang angka...
-
Dear kawan kawan……..kali ini saya akan membagi pengalaman bagaimana MUDAHNYA mendapatkan beasiswa unggulan!!! sebelumnya, saya akan memberi...
-
Dear kawan…… Kali ini kita akan membahas mengenai bagaimana memilih fase gerak untuk kromatografi lapis tipis. Memilih solven sebagai ...
-
Dalam sebuah karya ilmiah baik itu sebuah penelitian maupun karya tulis tentunya para peneliti harus memiliki sumber referensi. Sumber refer...
-
Pada petunjuk CPOB 2009 Bab Bagunan dan Fasilitas, disebutkan bahwa untuk mencegah kontamination silang ( cross contamination) hendaklah dia...
-
sebelum menginjak ke pelayanan obat tanpa resep kita harus tahu terlebih dahulu apa itu obat tanpa resep??? klo obat dengan resep i...
Penemuan obat sulfunylurea--> DM. ditemukan zaman perang dunia kedua..ditemukan secara kebetulan. Ditemukan ketika seseorang menggunakan obat sulfonamid (antibiotik popoler). Digunakan mengakibatkan efek samping penurunan kadar darah. Padahal belum ada obat keculai insulin. Kemudian diteliti, dan disintesis suatu senyawa yang masih mengandung sulfonamid, senyawa ini dinamakan tolbutamid. Penemuannya fenomenal karena belum ada obat diabetes kecuali insulin.
Farmakologi molekuler -->ilmu , lanjutan dari farmakologi dasar, ilmu yang mempelajari tentang obat. Kemudian Berkembang, ilmu yang mempelajari interaksi antara obat dan organisme hidup . Klo interaksi antara orang satu dengan orang lain, maka Saling mempengaruhi. Ketika obat berada didalam tubuh, obat mempengaruhi organisme hidup, dan organisme hidup mempengaruhi obat. Pengaruh obat thdp organisme hidup melakukan apa? Obat di dalam tubuh, oleh tubuh diapakan saja…
Tubuh terhadap obat akan melakukan ADME, manefestasi terhadap pengaruh organisme terhadap obat. Sebaliknya pengaruh obt thd tubuh, manifestasinya adalah suatu efek. Obat untuk menghasilkan efek harus bereaksi .bekerja, contoh CTM, mencegah adanya reaksi antialrgi, kerjanya menghambat antihistamin.
Dear teman…..dear kawan-kawan sejawat farmasi dan kawan-kawan tercinta…meninjau kebutuhan teman-teman profesi terutama untuk yang angkatan baru…terutama lagi angkatan lama yang sudah lupa – lupa, terutama angkatan yang belum punya uang buat beli buku Cara Pembuatan Obat yang Baik 2006 Maupun Petunjuk Operasional Cara Pembuatan Obat yang Baik 2009, maka dengan ini saya secara memfasilitasi free download CPOB 2006 & PCPOB 2009. Monggo…didownload dan dinikmati, serta di sebar luaskan…Selain itu, disini juga saya tambahkan catatan catatan sejarah yang saya tuliskan di blog karena terlalu mengganggur ketika PKL , hehehe..(sambil logat congkak dan sombong)…monggo dinikmati….
Oh iya….demi ilmu pengetahuan, kawan-kawan bisa request ingin tulisan apa…insyaallah saya akan tuliskan…!!!hehehe…..
Jauh yang lalu….aku tak mimiliki keberanian untuk bermimpi, memimpikan pendamping seperti dirimu. Membayangkan bagaimana indahnya kehidupan bersamamu, surut padam melihat kokohnya benteng yang harus aku lalui. Tak kurang dan tak lebih, hanya mampu sekedar menatap sekali tatap dan menundukkan pandang, entah….namun setiap papasan, engkau pun melakukan hal yang sama. Aku tahu, inilah norma, agama, dan kesucian yang menjadi benteng kokoh memanjang tak berujung dan tak tahu dimana pintunya, untuk memasukinya dengan salam. Tak mungkin aku merobohkan sebuah norma, agama, dan kesucian yang telah disusun semenjak engkau lahir.
Buku Panduan : CLARKE'S ANALYSSYS
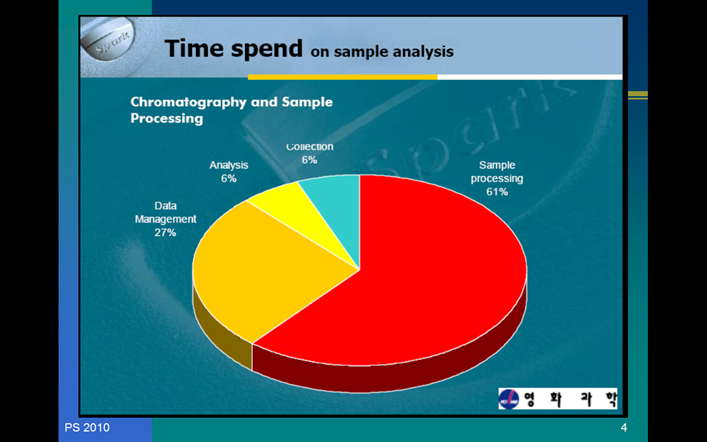
SAMPEL PREPARATION menjadi hal yagn benar - benar penting…
Menempati 61 persen dari waktu, maka dikaitkan dengan kesalahan yagn terjadi, hal ini sangat berperan.waktu untuk sampel prosesing juga panjang, maka disitulah kita akan berbuat kesalahan.Dengan demikian orang analitik diharapkan harus menempuh jalan yang pendek preparasi untuk menempuh analisis. Jika dikatakan dalam bahasa ilmiah, maka preparasi sampel memiliki prosesing error distribution yang sangat besar…
Bagaimana seharusnya menyiapkan sampel???
Chromosom, dna, antiprotein.
DNA merupakan penyusun kromosom. DNA berada dalam struktur kromosom yang terdapat didalam nukleus.
Gen merupakan fragmen dna didalam kromosom. Yang mengkode sesuatu protein adalah Gen,bukan DNA. DNA itu hanya pembawa sifat, tetapi yang memberikan sifat itu adalah protein.
DNA pada human ada di dalam mitokondria dan nukleus
Glukosa juga bisa menembus sel beta pankreas. Pada sel beta pankreas, terdapat tipe GLUT-2 , ini ready, berbeda dengan GLUT 4. dia ada selalu dimembrane sel beta pankreas. Otomatis glukosa masuk ke sel beta pankreas. Glukosa masuk ke sel betapankreas, berlangsung sama nasibnya dengan di sel – sel lainnya, yakni digunakan sebagai substrate metabolisme energi yang meng hasilkan ATP. ATP ini yang kemudian meng in aktivasi suatu kanal yang dinamakan ATP-sensitive K+ channel. (kanal potasioum yang sensiteive terhadap keberadaan ATP). Adanya ATP yang dihasilkan dari metabolisme energi mengakibatkan kanal potasium tertutup. Klo kanal potasium tertutup, maka (ion K+ yang lebih banyak didalam sel daripada diluar sel) maka potasium tidak bisa bergerak dari dalam ke luar sel sehingga kadar potasium didalam sel meningkat. Potasium ion positif, sehingga mengakibatkan potensial aksi/potensial listrik pada daerah intrasel. Depolarisasi terjadi. Akibatnya potensial meningkat yang mengaktivasi suatu channel voltage gates Ca+ channel. (adanya voltase membuka kanal calsium). Akiabtnya ion calsium masuk karena kadar didalam sel rendah. Klo kanal calsium terbuka, calsium masuk karena ion klsium jauh lebih banyak daripada didalam sel. Mengapa demikian? karena sel itu berupaya menjaga kadar ion ini serendah mungkin. Suatu sel menjaga dengan jalan mengeluarkan ion kalsium melalui proses kalsium eflux atau menyimpannya di dalam retikulum endoplasma. Kalsium masuk, akan terjadi Akan terjadi perubahan /fungsional/fisiologi didalam sel tersebut, salah satunya proses eksositosis granul yang mengandung insulin sehingga akan melepaskan insulin.
28,29-Didehydronystatin A1 (S44HP), a Genetically Engineered Antifungal Polyene Macrolide Antibiotic
Antimikroba adalah suatu senyawa yang dapat membunuh mikroorganisme. Terdapat berbagai macam penamaan fungsi atau daya membunuh mikroorganisme ini berdasarkan mekanisme, kandungan aktif atau mikroorganisme targetnya. Seperti antibiotika adalah senyawa yang dihasilkan mikroorganisme atau eukariot, yang dapat membunuh mikroorganisme dan antifungi merupakan senyawa yang dapat membunuh sel jamur
Dokumentasi merupakan salah satu bagian yang esensial dari pemastian mutu. Menurut CPOB 2006 Dokumentasi adalah bagian dari sistem informasi manajemen dimana berperan dalam pemastian bahwa tiap personil menerima urian tugas yang relevan secara jelas dan rinci sehingga dapat memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul Karena hanya mengandalkan komunikasi lisan.
Di dalam Petunjuk CPOB 2009 dalam bab Bangunan dan Fasilitas disebutkan bahwa
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu telah memenuhi ketentuan CPOB. Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan menetapkan tindakan perbaikan yang diperlukan.
Apa itu kalibrasi???
Kalibrasi adlaah kegiatan Membandingkan kesesuaian nilai yang dihasilkan suatu alat terhadap standar pada kondisi tertentu, bisa farmakope indonesia, USP, EP, maupun British parmacope.
Kalibrasi lebih mudah dilakukan secara desentrasilasi, yakni masing-masing bagian melakukan kalibrasi terhadap instrument/alat uji yang berada di bagiannya masing-masing. Di Industri Farmasi, biasanya yang mengurusi kalibrasi adalah Unit GMPC (Good Manufactured Pharmaceutical Complaince). GMPC akan membuat jadwal kalibrasi yang terdiri dari due date (batas waktu kalibrasi yang mengacu pada jadwal rutin kalibrasi), planning date (tanggal yang direncanakan yang umumnya dilakukan 3 hari sebelum due date), dan execution date (tanggal pelaksanaan kalibrasi yang berada di antara planning date dan due date). Pelaksanaan kalibrasi lebih baik saat planning date karena dikhawatirkan apabila telah due date alat tiba - tiba dipakai, maka alat bisa saja tidak sesuai dengan parameter standar.
Frekuensi kalibrasi direkomendasi oleh buku petunjuk operasional CPOB 2006, tetapi dapat pula mengacu kepada buku alat/referensi yang dikeluarkan oleh manufacturer dari alat tersebut. Frekuensi kalibrasi juga dapat dibuat secara internal dengan melakukan justifikasi berdasarkan penggunaan dan kritisasi penggunaan alat. Justifikasi ini harus memperoleh approval dari bagian QA. Instrument/alat yang harus dikalibrasi adalah alat/instrument yang digunakan untuk mengukur, menimbang, memeriksa, dan mencatat. Kalibrasi dilakukan setelah kualifikasi (kualifikasi desain, kualifikasi instalasi, kualifikasi operasional, dan kualifikasi kinerja) selesai dilakukan.
RETAIN SAMPEL BAHAN BAKU DAN PRODUK JADI INDUSTRI FARMASI & Ongoing Stability (CPOB 2006/PCPOB 2009)
Dear temen…kali ini andy akan membahas bahwa ternyata retain sampel produk jadi dan ongoing stability itu berbeda…serta guna retain sampel bahan baku…monggo….

1. Drinking Water
2. Purified Water
3. Highly Purified Water
4. Water for Injection
5. other grades of water
Perawatan berkembang sendiri sesuai dengan kebutuhan. Perawatan macamnya dibagi menjadi :
1. Breakdown Maintenance.
Kegiatan perawatan dilakukan saat mesin itu rusak. Apabila mesin tidak rusak maka G diperbaiki. Kelemahannya karena kita tidak bisa memprediksi kapan mesin rusak, akibatnya apabila mesin tersebut mesin produksi, maka produksi dapat terganggu. Di sini PPIC marah – marah karena target produksinya tidak tercapai.
Sesuai dengan namanya, NMR berhubungan dengan sifat magnet dari inti atom.
Dari pernyataan tersebut maka timbul pertanyaan, Kenapa Inti atom dapat bersifat magnet?
Untuk menjelaskan hal tersebut, mari kita bahas dari konsep dasarnya.
PRINSIP
Cukup jelas.
UMUM
3.1 Dalam memilih lokasi bangunan hendaklah diperhatikan apakah ada sumber pencemaran yang berasal dari lingkungan. Sebaiknya dipilih lokasi di mana tidak ada risiko pencemaran lingkungan. Bila karena perubahan struktur tanah, atau perencanaan kota, lingkungan pabrik tidak dapat dihindarkan dari pencemaran hendaklah diambil tindakan sebagai berikut:
| Lingkungan | Bentuk Cemaran misalnya : | Tindakan Pencegahan misalnya : |
| Udara | Berbagai jenis debu, misalnya debu jalan, debu dari industri lain dan partikel pestisida. | melengkapi sistem ventilasi dengan saringan udara awal dan saringan udara akhir yang masing-masing mempunyai efisiensi 30-40 % dan 90-95 % (diukur menurut ASHRAE) |
| Tanah | Bekas timbunan sampah dan bahan kimia. | - konstruksi bangunan yang kokoh dan kedap air sesuai dengan per-aturan bangunan yang berlaku; - bebas dari rembesan air, serangga, binatang pengerat serta dari kontaminan lain; dan - dilengkapi dengan saluran pem-buangan air yang efektif untuk mencegah banjir. |
| Air tanah | - Bekas timbunan bahan kimia. - Air sadah air yang mengan-dung zat koloid. - Mikroba patogen. | - semua bekas timbunan bahan harus digali dan dibuang sesuai dengan peraturan pemerintah yang berlaku, bekas penimbunan ini hendaklah dinetralisasi (misal: dengan kapur tohor); - pelunakan air; - sedimentasi dan penyaringan; - disinfeksi misal: dengan klorinasi |
3.2 Konstruksi bangunan hendaklah memenuhi syarat dan peraturan yang berlaku untuk bangunan. Hendaklah diadakan sarana perlindungan seperlunya terhadap:
| Lingkungan | Tindakan Pencegahan antara lain dengan |
| Cuaca | - memberikan cat tahan cuaca pada tembok; - memasang alat penyerap kelembaban udara secara pendinginan atau secara penyerapan oleh bahan kimia yang higroskopis. |
| Banjir | - mendesain letak bangunan dibuat cukup tinggi terhadap permukaan air banjir; - memasang saluran pembuangan air yang efektif. |
| Rembesan air | - memasang saluran pembuangan air yang efektif; - membuat pondasi dan lantai bangunan yang tahan rembesan air sesuai dengan tehnik bangunan yang berlaku. |
| Masuk dan bersarangnya binatang kecil, tikus, burung, serangga dan hewan lain | - memasang saringan udara pada alat pengendali udara; - memasang kawat kasa dan/atau tirai plastik; - melaksanakan pest control. Lihat contoh: · Protap Pemusnahan / Pencegahan Serangga, Lampiran 5.19a dan · Protap Pemusnahan/Pencegahan Tikus, Lampiran 5.19b. |
3.3 Bangunan dan fasilitas hendaklah dirawat secara teratur agar senantiasa bersih dan rapi. Contoh program pembersihan ruangan, lihat contoh Program Pembersihan Ruangan, Lampiran 3.3.
3.4 Setiap pelaksanaan perbaikan dianjurkan dilakukan di luar waktu kegiatan produksi.
3.5 Lihat Tabel Rekomendasi Jumlah Partikel di Lingkungan Produksi Nonsteril.
| Kelas | Nonoperasional | Keterangan | |
| Jumlah maksimum partilkel /m³ yang diperbolehkan untuk kelas setara atau lebih tinggi dari | |||
| 0,5µm (d) | 5µm | ||
| E | 3.500.000 | 20.000 | Jumlah mikroba ditetapkan oleh masing-masing industri farmasi, misal: ruang pengolahan dan pengemasan primer. |
| F | Tidak ditetapkan | Tidak ditetapkan | Ruang pengemasan sekunder yang tidak berhubungan langsung dengan area luar; untuk memasuki ruang ini disarankan melewati suatu ruang penyangga atau ruang lain. |
| G | Tidak ditetapkan | Tidak ditetapkan | Ruang penyimpanan (gudang). |
Lihat Rekomendasi Sistem Tata Udara Untuk Tiap Kelas Kebersihan, Lampiran 3.5a.
Lihat Rekomendasi Kekuatan Cahaya Untuk Ruangan/ Daerah Kegiatan, Lampiran 3.5b.
3.6 Desain dan Tata Letak Ruang
Lihat contoh:
· Rancangan Blok Bangunan Pabrik, Lampiran 3.6a;
· Tata Letak Ruang Produksi Nonsteril, Lampiran 3.6b;
· Tata Letak Ruang Produksi Steril dengan Proses Aseptis, Lampiran 3.6c; dan
· Tata Letak Ruang Produksi Steril dengan Proses Sterilisasi Akhir, Lampiran 3.6d.
a) Rancang-bangun hendaklah dibuat sehingga untuk kegiatan yang berhubungan langsung dengan daerah luar sarananya dikelompokkan. Kegiatan yang berhubungan langsung dengan daerah luar antara lain adalah:
· penerimaan bahan awal;
· keluar-masuk karyawan;
· pemakaian seragam kerja;
· mandi, cuci tangan dan buang air kecil;
· penyerahan produk jadi untuk distribusi.
Rancangan di atas perlu ditekankan agar tidak berdampak negatif terhadap kegiatan produksi yang dilakukan di area dengan kelas kebersihan lebih tinggi.
b) Tata letak ruang hendaklah dikaji sejak tahap perencanaan konstruksi bangunan demi keefektifan semua kegiatan, kelancaran arus kerja, komunikasi dan pengawasan serta untuk menghindari ketidakteraturan. Peralatan produksi, barang, dan fasilitas lain yang akan ditempatkan serta lalu-lintas barang dan orang hendaklah digambarkan dengan benar pada tata letak ruang sesuai dengan ukuran yang direncanakan.
3.7 Untuk mencegah penggunaan daerah produksi sebagai lalu-lintas umum bagi karyawan atau barang/bahan hendaklah disediakan koridor dari mana tiap ruang produksi dapat dicapai tanpa harus melalui ruang produksi lain. Untuk mencegah daerah produksi digunakan sebagai tempat penyimpanan hendaklah disediakan ruang penyimpanan yang memadai.
3.8 Cukup jelas. Lihat contoh Tata Letak Ruang Produksi Nonsteril, Lampiran 3.6b.
AREA PENIMBANGAN
3.9 Desain area penimbangan, lihat contoh Desain Area Penimbangan, Lampiran 3.9.
AREA PRODUKSI
3.10 Contoh produk yang dapat menimbulkan sensitisasi tinggi adalah golongan sefalosporin, karbapenem dan karbasefem. Untuk golongan ini dapat dibuat dalam satu bangunan dengan non betalaktam namun sistem HVAC terpisah.
Lihat contoh Rancangan Blok Bangunan Pabrik, Lampiran 3.6a.
Untuk pengolahan produk yang mengandung bahan yang menimbulkan sensitisasi tinggi dan senyawa immunosupresif hendaklah disediakan fasilitas tersendiri untuk masing-masing produk. Udara yang keluar dari fasilitas itu hendaklah dilewatkan melalui saringan udara HEPA dengan efisiensi minimal 99,5 % (class H12 EN1822) atau melalui suatu sistem yang sesuai sebelum dilepaskan ke atmosfir.
Bila produksi dari produk tersebut dilaksanakan dalam satu bangunan untuk non-betalaktam, tata ruang hendaklah diatur sedemikian rupa sehingga:
- daerah produksi untuk produk tersebut sama sekali dipisah dari daerah lain;
- keluar masuk karyawan dan bahan dipisah sama sekali dari keluar masuk untuk produk lain; dan
- sistem pengolahan udara yang terpisah tersedia.
3.11 Cukup jelas.
3.12 Cukup jelas. Lihat contoh Tata Letak Ruang Produksi Nonsteril, Lampiran 3.6b.
3.13 Lihat contoh Tata Letak Ruang Produksi Nonsteril, Lampiran 3.6b.
Luas area kerja produksi hendaklah minimal dua kali luas yang diperlukan untuk penempatan peralatan (termasuk wadah yang diperlukan untuk suatu kegiatan) ditambah luas area untuk keperluan pembersihan dan perawatan mesin oleh operator produksi dan/atau teknisi.
3.14 Permukaan lantai, dinding, langit-langit dan pintu hendaklah:
- kedap air;
- tidak terdapat sambungan untuk mengurangi pelepasan atau pengumpulan partikel;
- tidak merupakan media pertumbuhan mikroba;
- mudah dibersihkan serta tahan terhadap proses pembersihan, bahan pembersih dan disinfektan yang digunakan berulang kali dengan memperhatikan faktor kepadatan, porositas, tekstur dan sifat elektrostatis.
Untuk daerah pengolahan dan pengemasan primer hendaklah dihindari pemakaian bahan dari kayu. Bila terpaksa menggunakan bahan dari kayu hendaklah diberi lapisan misal cat poliuretan atau enamel. Lapisan cat tidak mudah mengelupas, lihat contoh Jenis Bahan Bangunan, Lampiran 3.15.
3.15 Cukup jelas. Lihat contoh Jenis Bahan Bangunan, Lampiran 3.15.
3.16 Lampu hendaklah rata dengan langit-langit dan diberi lapisan untuk mencegah kebocoran udara atau bila menonjol keluar mempunyai desain sudut yang mudah dibersihkan. Dianjurkan agar lampu dapat diperbaiki dari atas langit-langit. Colokan listrik hendaklah datar dengan permukaan dan kedap air agar tidak ada rongga atau celah dan dapat dibersihkan. Kabel listrik yang dihubungkan dengan mesin produksi hendaklah datang dari atas atau dari koridor yang berada sepanjang ruang produksi.
3.17 Cukup jelas.
3.18 Pipa saluran udara hendaklah dipasang di atas langit-langit atau di koridor untuk menghindari penumpukan debu yang sulit dibersihkan di permukaan pipa.
3.19 Lubang udara masuk dan keluar serta pipa-pipa dan salurannya hendaklah dipasang sedemikian rupa untuk mencegah pencemaran terhadap produk.
Lihat contoh Instalasi Lubang Udara Masuk, Lampiran 3.19.
3.20 Cukup jelas. Lihat contoh Desain Sistem Drainase, Lampiran 3.20.
3.21 Lihat Butir 3.5.
3.22 Sarana penunjang khusus dapat berupa sistem penghisap debu atau sarana yang dilengkapi LAF. Lihat contoh Sistem HVAC untuk Sarana Penimbangan Bahan, Lampiran 3.22.
3.23 Cukup jelas.
Untuk mencegah kontaminasi silang hendaklah diatur tekanan udara. Lihat contoh Kaskade Tekanan Udara Di Area Pengemasan Untuk Mencegah Kontaminasi , Lampiran 3.23.
3.24 Cukup jelas. Lihat Rekomendasi Kekuatan Cahaya Untuk Ruangan/ Daerah Kegiatan, Lampiran 3.5b
3.25 Disarankan mempunyai ruang tersendiri untuk pengawasan-selama-proses.
3.26 Cukup jelas. Lihat contoh Desain Pintu Darurat, Lampiran 3.26.
AREA PENYIMPANAN
3.27 Cukup jelas. Lihat contoh Desain Gudang Penyimpanan, Lampiran 3.27.
3.28 Cukup jelas.
3.29 Cukup jelas.
3.30 Area penerimaan dan pengiriman hendaklah terpisah dari area penyimpanan barang.
3.31 Sistem lain misalnya cara komputerisasi serta pemberian penandaan bar-code.
3.32 Cukup jelas. Lihat contoh Desain Ruang Pengambilan Sampel, Lampiran 3.32.
3.33 Cukup jelas.
3.34 Obat berbahaya lain, antara lain golongan psikotropika dan prekursor.
3.35 Cukup jelas.
AREA PENGAWASAN MUTU
3.36 Lihat contoh Desain Tata Letak Ruang Laboratorium Pengawasan Mutu, Lampiran 3.36
Sistem tata udara laboratorium pengawasan mutu hendaklah terpisah dari sistem tata udara area produksi.
Laboratorium fisiko-kimia, mikrobiologi, dan radioisotop hendaklah memiliki ruang tersendiri dengan sistim pengendali udara terpisah, karena perbedaan jenis pengujian, peralatan dan bahan-bahan penguji yang terdapat di laboratorium masing-masing. Di dalam laboratorium mikrobiologi perlu disediakan meja kerja dengan aliran udara laminar di dalam suatu ruang bersih (kelas D atau lebih tinggi) untuk pengujian potensi, cemaran mikroba. Untuk pelaksanaan uji sterilitas hendaklah dilakukan dalam kondisi aseptis. Kondisi ini dapat dicapai, misal, menggunakan lemari laminar air flow (kelas A) di dalam ruang bersih kelas B atau menggunakan teknik isolator.
3.37
s/d
3.39 Lihat butir 3.36.
AREA PENDUKUNG
3.40 Sangat dianjurkan agar fasilitas produksi yang menimbulkan sensitisasi (misal: penisilin) maupun sitotoksik mempunyai kantin tersendiri. Lihat contoh Rancangan Blok Bangunan Pabrik, Lampiran 3.6a.
3.41 Cukup jelas. Lihat contoh Skematik Ruang Ganti Pakaian, Lampiran 3.41
Lihat butir 5.14
3.42 Cukup jelas.
3.43 Cukup jelas. Lihat contoh Rancangan Blok Bangunan Pabrik, Lampiran 3.6a.
BAB 4
| P E R A L A T A N |
DESAIN DAN KONSTRUKSI
4.1 Bahan inert yang digunakan untuk bagian peralatan yang bersentuhan dengan bahan awal , produk antara atau produk ruahan antara lain adalah:
| B A H A N | UMUMNYA DIGUNAKAN UNTUK |
| (a) baja tahan karat AISI 304 (American Iron and Steel Institute 304) yang mengandung antara lain krom 18-20 % dan nikel 8-12 % | - peralatan atau bagian peralatan yang tidak bersentuhan langsung dengan bahan atau produk. |
| (b) baja tahan karat AISI 316 atau 316 L (L = low carbon) mengandung antara lain krom 16 – 18 %, nikel 10 – 14 % dan molibden 2 – 3 % dengan atau tanpa elektropolis | - pengolahan dan pengisian produk steril dan non steril; - sistem pemipaan untuk air murni dan air untuk injeksi. |
| (c ) gelas (juga untuk pelapis) | - pengolahan bahan baku yang bereaksi terhadap baja tahan karat |
| (d) Lain-lain, misalnya politetrafluoroetilen (PTFE); polypropylene (PP); polyvinylidenedifluoride (PVDF); dan perfluoroalkoxy. | - pengolahan bahan baku yang bereaksi dengan bahan di butir (a), (b), (c) tersebut di atas, tetapi tidak bereaksi dengan PTFE, PP, PVDF dan perfluoroalkoxy |
| (e) uPVC (unplasticized polyvinylchloride) | - untuk peralatan pengolahan air yang belum dimurnikan misal : tabung penukar kation-anion dan pelunak air. |
4.2 Cukup jelas.
4.3 Bahan pelumas jenis food grade hendaklah digunakan apabila ada kemungkinan bahan tersebut bersentuhan dengan produk, misal: pelumas untuk punch and die.
4.4 Cukup jelas.
4.5 Untuk memastikan kemudahan dan kesempurnaan pembersihan maka rancang bangun peralatan dibuat sedemikian rupa agar:
a. sederhana tapi sesuai dengan tujuan penggunaan, mudah dibongkar dan dipasang kembali sebelum dan setelah dibersihkan;
b. tidak ada bagian yang tidak terjangkau pada pembersihan;
c. tidak ada bagian yang menahan sisa produk atau larutan pencuci; dan
d. tidak berkarat dan tidak mudah tergores.
4.6 Untuk pencucian dan pembersihan dianjurkan menggunakan:
- lap bebas serat;
- mesin penghisap debu daripada udara bertekanan; dan
- sikat nylon daripada sikat ijuk.
4.7 Cukup jelas.
4.8 Semua motor peralatan dan instalasi listrik yang digunakan untuk mengolah bahan yang mudah terbakar hendaklah kedap ledakan dan dibumikan dengan benar, Lihat contoh:
- Perlengkapan Listrik Kedap Ledakan, Lampiran 4.8a ;
- Pembumian Wadah, Lampiran 4.8b; dan
- Pembumian Wadah Kecil, Lampiran 4.8c; dan
- Sistem Pembumian untuk Penanganan Pelarut Mudah Terbakar Volume Kecil, Lampiran 4.8d.
4.9 Cukup jelas. Lihat contoh Protap Kalibrasi dan Verifikasi Harian Timbangan, Lampiran 6.33.
4.10
s/d
4.11 Cukup jelas.
Pemasangan dan Penempatan
4.12 Di dalam satu ruangan hanya boleh ada satu atau satu set peralatan untuk satu produk agar tidak terjadi pencemaran silang.
4.13 Lihat butir 3.13.
4.14 Cukup Jelas.
4.15 Pemipaan adalah seluruh jenis pipa termasuk sambungan, katup dan insulator pipa. Semua pemipaan kecuali yang ditanam di bawah tanah dan pipa listrik hendaklah diberi tanda jelas.
Penandaan terdiri dari :
- Tulisan atau singkatan yang menunjukkan nama bahan yang terdapat dalam saluran;
- Tanda panah yang menunjukkan arah aliran bahan dalam pipa, terutama pada percabangan dan pada persilangan pipa; dan
- Warna yang spesifik untuk mengidentifikasikan bahan yang terdapat dalam saluran, lihat contoh Penandaan Pipa, Lampiran 4.15.
Penandaan hendaklah ditempatkan:
- dekat keran atau sambungan;
- bersebelahan dengan perubahan arah;
- pada percabangan;
- bila pipa menembus dinding atau lantai; dan
- pada jarak yang teratur pada saluran yang panjang.
4.16 Pemberian nomor pada peralatan diperlukan bila terdapat lebih dari satu mesin dari merk dan tipe yang sama. Peralatan utama yang perlu diberi nomor pengenal yang jelas antara lain:
- mesin pengaduk;
- alat pengering;
- mesin pencetak tablet;
- mesin penyalut; dan
- mesin pengemas strip.
4.17 Cukup jelas. Lihat contoh Protap Penandaan, Lampiran 6.13
Perawatan
4.18 Cukup jelas. Lihat contoh:
- Program Perawatan Peralatan, Lampiran 4.18a;
- Catatan Pemeliharaan Alat, Lampiran 4.18b; dan
- Catatan Perbaikan Alat, Lampiran 4.18c.
4.19 Waktu pelaksanaan perbaikan dan perawatan hendaklah disesuaikan dengan jadwal kegiatan produksi.
4.20 Hendaklah ditetapkan spesifikasi internal untuk bahan pendingin, pelumas dan bahan kimia lain yang digunakan untuk keperluan produksi.
4.21 Cukup jelas. Lihat contoh Protap Perawatan Mesin Cetak Tablet, Lampiran 4.21.
4.22 Cukup jelas. Lihat contoh Buku Log Pemakaian dan Perawatan Alat, Lampiran 4.22.
PRINSIP
Cukup jelas.
HIGIENE PERORANGAN
5.1 Cukup jelas, lihat Contoh Pakaian Pelindung Sesuai dengan Ruang Kelas Kebersihan, Lampiran 5.1. Untuk produk steril lihat Aneks 1, Pembuatan Produk Steril, Butir 34.
5.2 Cukup jelas, lihat Contoh Protap Memasuki Ruangan Produksi, Lampiran 5.2.
5.3 Cukup jelas, lihat Contoh Protap Mengenakan Pakaian Kerja untuk Area Produksi Non-Steril, Lampiran 5.3a.
Pakaian pelindung untuk pembuatan obat steril, lihat Aneks 1, Pembuatan Produk Steril, Butir 33.
Cukup jelas, lihat Contoh Gambar Pakaian Pelindung Personil untuk Pembuatan Obat Steril, Lampiran 5.3b.
5.4 Cukup jelas, lihat Contoh Program Higiene Perorangan, Lampiran 5.4.
5.5 Cukup jelas, lihat Contoh Program Pemeriksaan Kesehatan, Lampiran 5.5.
5.6 Cukup jelas, lihat Contoh Protap Penerapan Higiene Perorangan, Lampiran 5.6.
5.7 Hendaklah dibuat peraturan bahwa tiap personil yang mengidap penyakit atau mempunyai luka terbuka segera melapor kepada atasan langsung.
Tiap atasan hendaklah memastikan bahwa peraturan tersebut dilaksanakan secara konsisten dan mengamati apakah ada personil yang mengidap penyakit atau mempunyai luka terbuka.
5.8 Pelaporan keadaan yang dapat merugikan produk hendaklah dilakukan sesuai dengan suatu prosedur, lihat Contoh Protap Penanganan Penyimpangan, Lampiran 1.2k.2. Keadaan yang dapat merugikan produk lihat Keadaan Pabrik, Peralatan dan Personil yang Dapat Merugikan Produk, Lampiran 5.8.
5.9 Untuk menghindari persentuhan langsung antara tangan dengan bahan awal, produk antara atau produk ruahan yang terbuka operator hendaklah mengenakan sarung tangan yang tepat, misalnya sarung tangan karet atau plastik yang meliputi paling sedikit 10 cm dari pergelangan tangan dan utuh. (Sarung tangan yang dibuat dari kain tidak memadai karena berpori-pori).
5.10 Hendaklah dibuat prosedur tertulis untuk mencuci tangan sebelum memasuki area produksi dengan menggunakan sarana yang disediakan.
Lihat Contoh Protap Mencuci Tangan, Lampiran 5.10a.
Poster cara mencuci tangan hendaklah ditempatkan di lokasi yang tepat yaitu di area cuci tangan sebelum memasuki area produksi. Lihat Contoh Poster Cara Mencuci Tangan, Lampiran 5.10b.
Hendaklah disiapkan disinfektan yang dipilih untuk digunakan dalam prosedur mencuci tangan. Disinfektan yang dipilih hendaklah dirotasikan untuk mencapai efektifitas yang diinginkan. Pilihan disinfektan lihat Spektrum Antimikrobial dan Karakteristik Bahan Antiseptik, Lampiran 5.10c.
5.11 Di area produksi, area gudang, laboratorium dan area lain dapat disediakan ruangan khusus hanya untuk air minum dan diberi tanda.
5.12 Cukup jelas.
SANITASI BANGUNAN DAN FASILITAS
5.13 Lihat Bab 3, Butir 3.14.
5.14 Hendaklah disediakan toilet untuk pria dan wanita yang terpisah. Oleh karena persyaratan higiene bagi personil produksi yaitu yang bekerja di area kelas kebersihan lebih tinggi, relatif lebih ketat maka letak toilet tersebut hendaklah di area loker sebelum masuk ke ruang ganti pakaian bersih untuk masuk ke area produksi, lihat contoh Tata Letak Ruang Produksi Nonsteril, Lampiran 3.6b.
Jumlah minimum toilet yang dianjurkan berdasarkan jumlah personil adalah :
| Jumlah Personil | Jumlah Minimum Toilet yang Diperlukan |
| 1 – 15 | 1 |
| 16 – 35 | 2 |
| 36 – 55 | 3 |
| 56 – 80 | 4 |
| 81 – 110 | 5 |
| 111 – 150 | 6 |
| Lebih dari 150 orang : tambah satu toilet untuk setiap penambahan 40 orang personil. |
Ventilasi hendaklah sanggup menghilangkan bau yang timbul di ruang toilet yakni 10 x pertukaran/jam (Section R432-6-22. Mechanical, Heating, Cooling and Ventilation Systems, ASTM E90 dan E413).
Hendaklah disediakan tempat cuci tangan yang cukup bagi personil, yang dilengkapi dengan antara lain :
- air bermutu air minum,
- sabun antiseptik (umpama yang mengandung kloroksilenol 0,5% b/b) atau sabun cuci tangan cair, dan
- alat pengering tangan atau tisu sekali pakai atau handuk yang setelah dipakai dicuci kembali.
5.15 Sarana penyimpanan pakaian rumah hendaklah didesain sedemikian rupa sehingga ada pemisahan kompartemen penyimpanan pakaian dan sepatu. Kompartemen penyimpanan hendaklah dilengkapi dengan sistem ventilasi yang dapat menghilangkan bau dan kelembaban serta sistem yang dapat menampung kotoran atau debu yang mungkin lepas dari sepatu.
Lihat Contoh Gambar Sarana Penyimpanan Pakaian Rumah, Lampiran 5.15a dan Contoh Gambar Sarana Penyimpanan Sepatu Rumah, Lampiran 5.15b.
5.16 Cukup jelas.
5.17 Hendaklah ada prosedur dan jadwal pengosongan dan pembersihan tempat sampah, yang dilengkapi dengan penandaan, untuk menghindarkan penumpukan sampah.
5.18 Cukup jelas.
5.19 Cukup jelas, lihat :
§ Contoh Protap Pemusnahan Serangga, Lampiran 5.19a;
§ Contoh Protap Pemusnahan Tikus, Lampiran 5.19b ;
§ Bahan Pestisida & Rodentisida yang Terdaftar di Departemen Pertanian RI, Lampiran 5.19c; dan
§ Bahan Insektisida yang Terdaftar di Departemen Pertanian RI, Lampiran 5.19d.
5.20 Hendaklah disiapkan prosedur pembersihan dan sanitasi untuk tiap ruangan (bukan prosedur yang berlaku bagi lebih dari satu ruangan, meskipun dengan kelas kebersihan yang sama) yang mencakup pembersihan/sanitasi perabot dan barang-barang-kecuali mesin-yang diletakkan dan/atau dipasang dalam ruangan berkaitan. Lihat Contoh Protap Sanitasi Ruang Pencetakan Tablet, Lampiran 5.20a.
Bahan yang digunakan untuk membersihkan dan untuk sanitasi hendaklah dipilih sedemikian rupa sehingga tidak merugikan produk (mudah dihilangkan, tidak meninggalkan residu). Khusus terhadap bahan yang digunakan untuk sanitasi (yakni desinfektan) hendaklah dilakukan rotasi dalam interval tertentu. Lihat :
Daftar Bahan Disinfektan untuk Sanitasi, Lampiran 5.20b; dan
Daftar Beberapa Bahan Pembersih untuk Sanitasi, Lampiran 5.20c.
5.21 Cukup jelas.
5.22 Praktik tidak higienis di area pembuatan atau area lain yang dapat berdampak merugikan terhadap mutu produk, antara lain :
a) Kesehatan personil:
Personil bekerja dalam kondisi tidak sehat seperti mengidap penyakit infeksi pada saluran pernafasan bagian atas, influenza (batuk pilek), terkena alergi. Juga dalam keadaan mempunyai luka terbuka, bercak-bercak, gatal, bisul atau penyakit kulit lain. Bila baru sembuh dari suatu penyakit menular atau baru kembali dari daerah wabah penyakit menular hendaklah dinyatakan layak bekerja oleh dokter sebelum bekerja di area pembuatan atau area lain yang dapat berdampak merugikan terhadap mutu produk.
b) Higiene perorangan:
Melakukan praktik kebiasaan non-higienis/buruk seperti :
Ø membersihkan hidung atau telinga dengan jari tangan;
Ø menggaruk kepala;
Ø tidak mematuhi prosedur mencuci tangan sebelum memasuki area pembuatan;
Ø tidak mematuhi prosedur mencuci tangan sesudah dari toilet;
Ø tidak mematuhi prosedur pemakaian tutup kepala sebelum memasuki ruangan produksi;
Ø bersin tanpa ditutup dengan masker atau tidak keluar dari ruangan pengolahan; dan
Ø mengunyah, makan, minum atau merokok.
c) CPOB
Ø tidak mengenakan alat pelindung yang disediakan perusahaan sesuai dengan prosedur pada waktu menangani produk terbuka; dan
Ø tidak mengenakan pakaian kerja sesuai prosedur.
5.23 Lihat Pembuatan Produk Steril, Aneks 1.
PEMBERSIHAN DAN SANITASI PERALATAN
5.24 Lihat Butir 5.27 serta Contoh Label Bersih untuk Peralatan, Lampiran 5.24.
Peralatan yang sudah dibersihkan :
a) hendaklah disimpan dalam keadaan bersih dan kering (keadaaan lembab atau basah merupakan kondisi yang baik untuk pertumbuhan bakteri);
b) sambil menunggu pemakaian selanjutnya hendaklah diberi penutup bersih dan kering dari bahan yang tidak melepaskan serat, misalnya bahan plastik, khusus untuk peralatan tersebut; dan
c) disimpan di ruangan yang tingkat kebersihannya sama dengan tingkat kebersihan waktu peralatan tersebut digunakan.
5.25 Penggunaan udara bertekanan dapat mengakibatkan partikel menyebar.
5.26 Cukup jelas.
5.27 Cukup jelas, lihat Contoh Protap Pembersihan Mesin Cetak Tablet, Lampiran 5.27.
5.28 Catatan mengenai pelaksanaan pembersihan, sanitasi, sterilisasi dan inspeksi sebelum penggunaan peralatan merupakan bagian dari log book.
5.29 Cukup jelas.
VALIDASI PROSEDUR PEMBERSIHAN DAN SANITASI
5.30 Lihat Butir 12.35 s/d 12.39
BAB 6
|
PRINSIP
Cukup jelas.
UMUM
6.1 Cukup jelas, lihat Butir 2.1.
6.2 Cukup jelas, lihat contoh:
· Protap Penerimaan dan Penyimpanan Bahan Awal dan Bahan Pengemas, Lampiran 6.2a;
· Protap Penimbangan dan Penyerahan Bahan Awal untuk Produksi, Lampiran 6.2b;
· Protap Pengolahan dan Pengemasan, Lampiran 6.9; dan
· Protap Pengambilan Sampel Bahan Awal, Lampiran 7.23.
6.3 Cukup jelas, lihat contoh Protap Penandaan, Lampiran 6.13.
6.4 Masalah lain misal: wadah tidak berlabel, salah label, label tidak jelas, label ganda dan segel rusak.
6.5 Cukup jelas.
6.6 Dalam hal ini produk antara dan produk ruahan yang diterima adalah yang dibeli dari luar industri. Lihat Butir 6.2.
6.7 Cukup jelas, lihat contoh Protap Penerimaan dan Penyimpanan Bahan Awal dan Bahan Pengemas, Lampiran 6.2a.
6.8 Cukup jelas.
6.9 Cukup jelas, lihat contoh Protap Pengolahan dan Pengemasan, Lampiran 6.9.
6.10 Cukup jelas.
6.11 Pencegahan terhadap penyebaran debu akibat pengolahan bahan atau produk kering dapat dilakukan dengan alat atau sistem penghisap debu selama proses pengolahan. Operator hendaklah terlindungi terutama terhadap bahan yang sangat aktif atau dapat menyebabkan sensitisasi dengan masker dan alat pelindung khusus. Lihat contoh Pakaian Pelindung Sesuai dengan Ruang Kelas Kebersihan, Lampiran 5.1.
6.12
dan
6.13 Cukup jelas, lihat contoh Protap Penandaan, Lampiran 6.13.
6.14 Cukup jelas.
6.15 Lihat Butir 1.2.
6.16 Cukup jelas.
6.17 Fasilitas pembuatan obat dapat juga digunakan untuk produk nonobat, misal: kosmetik, produk komplemen (complimentary products) dan obat tradisional nonsimplisia.
BAHAN AWAL
6.18 Hendaklah dibuat daftar pemasok yang disetujui dan nama pemasok dapat dicantumkan dalam spesifikasi bahan.
6.19 Lihat Butir 10.21. Pilihan lain yaitu dengan sistem komputerisasi yang tepat dapat digunakan untuk pengawasan dan pencatatan bahan awal yang keluar dan masuk.
6.20 Cukup jelas.
6.21 Tiap penerimaan atau tiap bets bahan awal hendaklah diberi nomor referensi (misal: control number) yang ditetapkan oleh Bagian Pengawasan Mutu.
6.22 Cukup jelas.
6.23 Lihat Butir 6.2.
6.24 Lihat Butir 6.13.
6.25 Lihat Butir 7.33.
6.26 Cukup jelas.
6.27 Cukup jelas.
6.28 Lihat Butir 6.13. Jika menggunakan sistem komputerisasi, label “Diluluskan” dapat berupa bar-code.
6.29
s/d
6.30 Cukup jelas, lihat contoh Protap Penandaan, Lampiran 6.13.
6.31 Tergantung dari kestabilan bahan awal, penyimpanan hendaklah dilakukan dalam ruangan atau tempat yang suhunya diatur. Untuk penyimpanan hendaklah tersedia ruang dengan suhu berbeda-beda antara lain dengan:
suhu ruang (ambient) : £ 30°C;
suhu ruang berpendingin udara (AC) : ≤ 25°C;
dingin : 2o - 8°C ; dan
beku : di bawah 0°C.
Kondisi penyimpanan hendaklah disesuaikan dengan yang tercantum pada label bahan awal atau sesuai dengan sifat fisik dan kimia bahan tersebut.
Lihat contoh Protap Penyimpanan Bahan Awal, Lampiran 6.31.
6.32 Cukup jelas.
6.33 Cukup jelas, lihat contoh Protap Kalibrasi dan Verifikasi Harian Timbangan, Lampiran 6.33
6.34 Bahan awal yang “ditolak” hendaklah disimpan di tempat khusus yang dikunci.
Untuk memudahkan pengendalian bahan awal yang ditolak atau tidak diluluskan ini hendaklah diberi label yang jelas dan berbeda dengan label lain, lihat Butir 6.13.
VALIDASI PROSES
6.35
s/d
6.36 Lihat Bab 12. Kualifikasi dan Validasi.
6.37 Lihat Butir 12.44.
6.38 Cukup jelas.
PENCEGAHAN PENCEMARAN SILANG
6.39
s/d
6.41 Cukup jelas.
6.42 Tindakan pencegahan terhadap pencemaran silang dan efektifitasnya hendaklah diperiksa secara berkala, misal dengan melakukan:
- pemeriksaan rutin pada saringan udara apakah masih baik, bocor atau sudah harus diganti;
- pemeriksaan lingkungan terhadap kemungkinan pencemaran; dan
- pemeriksaan perbedaan tekanan udara antar-ruang, terutama ruang penyangga.
Lihat contoh:
- Protap Pemantauan Lingkungan Produksi dengan Cawan Papar, Lampiran 7.37b.1;
- Protap Pengujian Cara Apus, Lampiran 7.37b.2; dan
- Protap Pemantauan Lingkungan terhadap Mikroba, Lampiran 7.37b.3.
SISTEM PENOMORAN BETS / LOT
6.43
dan
6.44 Cukup jelas, lihat contoh Protap Pemberian Nomor Bets/Lot, Lampiran 6.43.
6.45 Yang dimaksud dengan tidak diperkenankan memakai nomor bets atau nomor lot yang sama adalah selama periode waktu tertentu, yaitu paling sedikit dalam jangka waktu 10 tahun. Untuk bets yang diolah ulang hendaklah diberikan kode tambahan terhadap nomor bets tersebut, misal: penambahan huruf P (pengolahan ulang)
6.46 Cukup jelas.
PENIMBANGAN DAN PENYERAHAN
6.47 Cukup jelas.
6.48 Cukup jelas, lihat contoh Protap Penimbangan dan Penyerahan Bahan Awal untuk Produksi, Lampiran 6.2b.
6.49 Pencatatan dapat dilakukan secara manual atau secara elektronik/komputer yang tervalidasi. Lihat contoh Formulir Permintaan Bahan, Lampiran 6.49.
6.50
dan
6.51 Cukup jelas.
6.52 Lakukan pemeriksaan kesiapan jalur penimbangan sebelum proses penimbangan. Lihat contoh Daftar Periksa Kesiapan Jalur Penimbangan, Lampiran 6.52. Label pelulusan dapat juga berupa label “Diluluskan” turunan (Lihat contoh Protap Penandaan, Lampiran 6.13) yang ditempelkan pada wadah bahan baku yang tidak diberi label “Diluluskan”.
6.53
s/d
6.57 Cukup jelas, lihat contoh Protap Penimbangan dan Penyerahan Bahan Awal untuk Produksi, Lampiran 6.2b.
6.58 Sesudah ditimbang atau dihitung, semua bahan untuk tiap bets hendaklah disimpan dalam satu kelompok, biasanya di atas satu palet atau kalau lebih dari satu palet, palet-palet tersebut didekatkan satu sama lain sehingga merupakan satu kelompok bahan untuk satu bets. Kemudian, kelompok bahan untuk satu bets tersebut diberi penandaan yang jelas.
PENGEMBALIAN
6.59 Bahan awal, produk antara dan produk ruahan yang dikembalikan hendaklah diberi penandaan, jumlahnya diperiksa kembali dan disetujui oleh petugas yang diberi wewenang.
Bahan pengemas yang telah diberi kode tidak boleh disimpan kembali.
Bahan awal yang telah dikeluarkan dari wadah aslinya serta dipindahkan ke dalam wadah lain dan diberi label “Kemas Ulang” dapat dikembalikan ke ruang penyimpanan atau tetap disimpan di ruang penyimpanan yang terdapat dalam area produksi.
Lihat contoh Protap Penandaan label “Kemas Ulang”, Lampiran 6.13.
6.60 Cukup jelas.
PENGOLAHAN
6.61 Cukup jelas.
6.62 Pada saat proses pengolahan suatu produk di suatu ruang pengolahan, hendaklah tidak memasukkan bahan lain selain bahan untuk bets yang sedang diolah tersebut. Bahan/produk lain hanya dapat dimasukkan ke dalam ruang pengolahan tersebut bila ruang pengolahan tersebut telah bebas dari produk sebelumnya dan ruangan serta peralatan telah dibersihkan. Protap dan dokumentasi hendaklah dibuat untuk mencapai tujuan ini.
Lihat contoh Protap Pencegahan Pencemaran Silang dan Campur Baur Selama Pengolahan, Lampiran 6.62.
6.63 Pemantauan kondisi daerah pengolahan dan langkah yang harus dilakukan sebelum mulai proses pengolahan hendaklah menggunakan suatu daftar periksa yang mencakup antara lain kebersihan ruangan dan peralatan, perbedaan tekanan antar ruangan, bebas dari bahan dan produk sebelumnya, bila perlu suhu dan kelembaban nisbi. Lihat contoh Daftar Periksa Kesiapan Jalur Pencampuran. Lampiran 6.63.
6.64 Lihat butir 6.63 dan lampirannya. Peralatan yang telah dibersihkan hendaklah diberi penandaan yang sesuai.
Lihat contoh Label status kebersihan ruangan dan mesin produksi, lampiran 4, dalam Protap Penandaan, Lampiran 6.13.
6.65 Semua kegiatan pengolahan dan kejadian yang terjadi di luar prosedur yang ditetapkan hendaklah dicatat pada catatan pengolahan bets disertai alasan dan penjelasan penyebab penyimpangan tersebut terjadi dan hal ini dilaporkan kepada kepala bagian Produksi.
Lihat contoh Protap Penanganan Penyimpangan, Lampiran 1.2k.2
6.66 Wadah dan penutup yang digunakan untuk bahan yang akan diolah hendaklah terbuat dari bahan yang inert antara lain polietilen, kaca, baja tahan karat (dianjurkan SS316 atau SS316L). Bahan tersebut tidak berpori, mudah dibersihkan dan bukan merupakan media pertumbuhan mikroba.
6.67
dan
6.68 Lihat Butir 6.13.
6.69 Pencatatan seluruh hasil pengawasan-selama-proses hendaklah dilakukan pada catatan pengolahan bets bersangkutan atau pada suatu formulir pengawasan-selama-proses. Lihat Butir 7.38.
6.70 Jika terjadi penyimpangan terhadap hasil nyata, penanganannya lihat Butir 6.65.
6.71 Lihat Butir 6.39 s/d 6.42 tentang Pencegahan Pencemaran Silang.
6.72 Batas waktu dan kondisi penyimpanan produk-dalam-proses (produk antara sebelum dilakukan pengemasan primer) hendaklah ditetapkan agar produk tidak mengalami penurunan mutu selama penyimpanan sebelum dilakukan proses selanjutnya. Penetapan batas waktu dan kondisi penyimpanan tersebut hendaklah divalidasi. Lihat contoh Protap Kondisi Penyimpanan Produk Antara dan Produk Ruahan, Lampiran 6.72.
6.73 Hendaklah disiapkan sistem manual tervalidasi untuk mengganti sistem komputerisasi kritis yang tidak berfungsi.
BAHAN DAN PRODUK KERING
6.74 Cukup jelas.
6.75 Cukup jelas.
6.76 Sebelum dan sesudah pengolahan petugas produksi hendaklah memeriksa antara lain: ayakan, punch dan die mesin tablet terhadap kerusakan atau keausan yang dapat menimbulkan serpihan logam dalam produk. Instruksi tertulis yang sesuai dapat dimasukkan dalam prosedur tetap atau dalam prosedur pengolahan induk.
Jika pada waktu selesai pengolahan diketahui ada kerusakan pada alat pengolahan yang digunakan, serpihan alat ini hendaklah ditemukan secara lengkap sebelum proses dilanjutkan. Bila perlu alat pendeteksi logam dapat digunakan. Kejadian seperti ini hendaklah dicatat pada catatan pengolahan bets.
6.77 Pemeriksaan kemungkinan adanya tablet atau kapsul yang terselip pada alat hendaklah tercantum dalam pemeriksaan kesiapan jalur atau dalam prosedur pengolahan bets.
Pencampuran dan Granulasi
6.78 Cukup jelas.
6.79 Lihat Butir 10.16.
6.80 Untuk mencegah pencemaran lingkungan dan pencemaran silang udara yang keluar dari alat pengering fluid bed drier hendaklah disaring melalui:
Ø filter debu dengan klasifikasi F9 – EN 779 untuk produk yang berpotensi rendah;
Ø filter HEPA dengan klasifikasi H12 – EN 1822 untuk produk yang berisiko tinggi, misal penisilin, hormon dan serbuk toksis.
6.81 Untuk menghindari risiko pertumbuhan mikroba pada larutan atau suspensi dianjurkan agar antara lain:
1. larutan atau suspensi dibuat segera sebelum digunakan dan dibuat secukupnya agar habis dipakai pada hari yang sama;
2. jika suspensi mengandung bahan nabati atau hewani, bahan awal ini hendaklah tidak mengandung mikroba lebih dari 1000 unit pembentuk koloni (cfu) tiap gram atau ml bahan dan tidak mengandung mikroba patogen misalnya Pseudomonas aeruginosa, Staphylococcus aureus, Salmonella atau bakteri koliform;
3. bila perlu, dapat ditambahkan bahan pengawet yang diizinkan; dan
4. wadah larutan atau suspensi hendaklah ditutup rapat.
Pencetakan Tablet
6.82 Untuk mengendalikan debu biasanya digunakan alat penghisap debu yang dilengkapi dengan filter HEPA.
6.83 Pemeriksaan kesiapan jalur pencetakan tablet dilakukan sebelum pencetakan tablet dilaksanakan. Lihat contoh Daftar Periksa Kesiapan Jalur Pencetakan Tablet, Lampiran 6.83.
6.84 Lihat Butir 6.33.
6.85 Cukup jelas.
6.86 Cukup jelas.
6.87 Tiap kali sebelum dipakai, punch dan die hendaklah diperiksa terhadap keausan dan kerusakan, di samping itu hendaklah secara berkala diperiksa pula tinggi punch dan diameter lubang die. Jika ukurannya sudah di luar batas toleransi yang ditetapkan, punch dan die hendaklah tidak digunakan lagi karena dapat menimbulkan variasi berat tablet yang besar. Tiap hasil pengukuran punch dan die tablet hendaklah dicatat. Catatan hasil pengukuran ini hendaklah disimpan.
Penyalutan
6.88 Filter yang dipakai untuk menyaring udara yang dialirkan ke dalam panci penyalut hendaklah mempunyai efisiensi paling sedikit 95 %.
Suhu udara pengeringan yang dialirkan berpengaruh terhadap mutu hasil penyalutan, sehingga perlu dipantau dan dicatat.
6.89 Lihat Butir 6.81.
Pengisian Kapsul Keras
6.90 Untuk menjaga kestabilan, cangkang kapsul hendaklah disimpan dalam ruangan bersuhu 15° - 25°C dengan kelembaban nisbi antara 40 % - 60 %.
6.91 Cukup jelas.
Penandaan Tablet Salut dan Kapsul
6.92 Pada satu jalur hanya diizinkan satu macam produk dan satu bets pada satu waktu, kalau tidak hendaklah diberi pemisah. Pemisahan hendaklah dilakukan dengan menggunakan partisi setinggi minimum 1 m.
6.93 Hendaklah tersedia dokumen untuk membuktikan tinta yang digunakan adalah tinta yang diperbolehkan untuk dipakai pada produk makanan.
6.94 Lihat Butir 6.92.
CAIRAN, KRIM DAN SALEP (non-steril)
6.95 Karena sifat alamiah produk, maka untuk melindungi produk dari pencemaran mikroba dianjurkan agar semua alat yang berhubungan langsung dengan produk didisinfeksi lebih dahulu sebelum dipakai, misal dengan alkohol 70%, isopropanol atau hidrogen peroksida 3%.
6.96 Untuk mencegah ada sambungan mati (deadlegs), sambungan hendaklah tidak lebih panjang dari 2 kali diameter pipa sampai katup.
Hendaklah menggunakan jenis katup diafragma atau katup kupu-kupu dan bukan katup bola.
6.97 Cukup jelas.
6.98 Air yang digunakan untuk produksi hendaklah memenuhi persyaratan minimal kualitas Air Murni (Purified Water). Parameter kimia dan mikrobiologi hendaklah dipantau secara teratur minimal seminggu sekali, sedangkan pH dan konduktivitas hendaklah dipantau tiap hari. Terhadap data hasil pemantauan harus dilakukan analisis kecenderungan (trend analysis). Lihat Persyaratan Air Untuk Produksi, Lampiran 6.98a.
Sanitasi sistem pengolahan air dapat dilakukan dengan cara:
Ø Pemanasan
Ø Kimiawi
Untuk sanitasi dengan cara pemanasan, lihat contoh Protap Sanitasi Sistem Pengolahan Air Murni, Lampiran 6.98b.
6.99 Tiap pipa transfer hendaklah diberi penandaan yang jelas dengan mencantumkan identitas produk.
6.100 Cukup jelas.
6.101 Cukup jelas.
6.102 Homogenitas hendaklah dipertahankan selama pengisian dengan pengadukan terus menerus sejak awal sampai akhir proses pengisian.
6.103 Kondisi penyimpanan produk antara dan produk ruahan hendaklah disesuaikan untuk menghindari perubahan mutu produk. Jangka waktu dan kondisi penyimpanan produk antara hendaklah divalidasi.
Lihat Butir 6.72.
BAHAN PENGEMAS
6.104 Cukup jelas.
6.105 Cukup jelas.
6.106 Tiap penerimaan atau tiap bets bahan pengemas hendaklah diberi nomor referensi (misal: control number) yang ditetapkan oleh Bagian Pengawasan Mutu.
6.107 Bahan yang akan dimusnahkan hendaklah ditempatkan di area terpisah, diberi label “Ditolak” dan dikeluarkan dari sistem persediaan. Tindakan ini untuk menghindari kesalahan pengambilan bahan pengemas. Sistem persediaan dapat dibuat secara manual atau elektronis yang mencakup antara lain:
a). nomor kode dan nama bahan atau produk;
b). tanggal penerimaan dan pengeluaran atau penyerahan;
c). jumlah penerimaan atau penyerahan dan sisa persediaan;
d). nomor bets/lot;
e). nama pemasok;
f). tanggal daluwarsa atau uji ulang;
g). status bahan, apakah karantina, diluluskan atau ditolak.
6.108 Yang boleh dimasukkan ke dalam ruang kodifikasi pada saat yang sama hanya bahan pengemas cetak atau bahan cetak yang akan dipakai untuk satu bets dari satu sediaan dan dari satu produk yang bersangkutan untuk menghindari campur baur.
KEGIATAN PENGEMASAN
6.109
dan
6.110 Cukup jelas, lihat contoh Protap Pelaksanaan Pengemasan, Lampiran 6.110.
6.111
dan
6.112 Lihat Butir 6.117 dan contoh Daftar Periksa Kesiapan Jalur Pengemasan, Lampiran 6.117
Pra-kodifikasi Bahan Pengemas
6.113 Setiap bahan pengemas sebelum dan sesudah pra-kodifikasi hendaklah dihitung dan dicatat. Sebelum proses pra-kodifikasi dimulai, supervisor hendaklah memeriksa kebenaran bahan pengemas yang diperlukan serta nomor bets atau lot, tanggal daluwarsa dan informasi lain yang diperlukan. Pemeriksaan ini hendaklah dilakukan oleh dua orang secara terpisah. Pemusnahan bahan pengemas yang tidak layak pakai hendaklah dilakukan setelah proses rekonsiliasi dan dicatat pada catatan pengemasan bets.
6.114 Cukup jelas.
6.115 Cukup jelas.
6.116 Cukup jelas.
Kesiapan Jalur
6.117 Untuk keperluan pemeriksaan dan kesiapan jalur pengemasan diperlukan suatu prosedur tetap. Lihat contoh Daftar Periksa Kesiapan Jalur Pengemasan, Lampiran 6.117.
Praktik Pengemasan
6.118 Cukup jelas.
6.119 Pemisahan secara fisik dapat dilakukan antara lain dengan :
- jarak antara jalur pengemasan paling sedikit 1,5 m diukur dari sisi terluar, atau
- diberi sekat pemisah dengan tinggi minimum 1 m dari lantai.
6.120 Cukup jelas.
6.121 Lihat Butir 6.67
6.122 Cukup jelas.
6.123 Cukup jelas.
6.124 Lihat Butir 5.17 dan 5.25
6.125 Cukup jelas.
6.126 Cukup jelas.
6.127 Lihat butir 6.67
6.128 Cukup jelas, lihat contoh Protap Pembersihan Mesin Label Otomatis, Lampiran 6.128
6.129 Untuk mencegah penyebaran debu dari pengemasan produk yang tidak berisiko tinggi dapat digunakan sistim penghisap debu. Pada pengemasan produk yang berisiko tinggi, penggunaan penghisap debu saja tidaklah cukup, tetapi hendaklah disediakan ruangan tertutup dan terpisah dari ruangan lain.
6.130 Jika menggunakan sikat hendaklah digunakan alat vakum pada pembersihan akhir untuk menghisap partikel yang tersisa pada alat.
6.131 Pakaian kerja sebaiknya tidak dilengkapi dengan saku. Apabila harus menggunakan saku, hendaklah saku tersebut dilengkapi dengan penutup. Lihat Butir 5.3.
6.132 Cukup jelas.
Penyelesaian Kegiatan Pengemasan
6.133 Cukup jelas.
6.134 Satu palet hanya boleh dipakai untuk menyimpan satu macam produk dan dari lot atau bets yang sama. Jika pada satu palet disimpan satu macam produk dengan lot atau bets yang berbeda, hendaklah disusun sedemikian rupa agar terdapat pemisahan yang memadai, misal dengan menggunakan penyekat berupa jala atau sekat lain yang tepat.
6.135 Sebelum dikembalikan ke gudang untuk dimanfaatkan kembali, kelebihan bahan pengemas hendaklah diperiksa secara teliti. Bahan pengemas yang dikembalikan ke gudang hendaklah disimpan dalam suatu wadah yang terpisah, ditandai secara jelas dengan nama produk, nomor bets, nomor analisis, jumlah dan keterangan lain yang diperlukan. Sisa bahan pengemas yang telah diberi kodifikasi, bahan pengemas dan bahan cetak yang rusak, kotor atau penampilannya tidak sesuai dengan spesifikasi yang ditentukan tidak boleh dikembalikan ke gudang dan hendaklah dimusnahkan untuk mencegah campur-baur, penggunaan kembali dan penyalahgunaan.
Produk ruahan yang dikembalikan ke gudang hendaklah ditempatkan dalam suatu wadah terpisah dan diberi tanda yang jelas, antara lain dengan nama produk, nomor bets, jumlah dan keterangan lain yang diperlukan.
6.136
dan
6.137 Lihat Butir 6.125.
6.138 Lihat Butir 6.65.
6.139 Produk dalam status karantina hendaklah diberi label “karantina” dan disimpan dalam rak khusus untuk karantina atau di tempat yang diberi tanda khusus sehingga mudah dibedakan dengan produk yang telah diluluskan.
PENGAWASAN SELAMA PROSES
6.140 Cukup jelas.
6.141 Lihat Butir 7.38.
6.142 Cukup jelas.
6.143 Lihat Butir 7.21 dan 7.22.
6.144 Cukup jelas.
6.145 Cukup jelas.
BAHAN DAN PRODUK YANG DITOLAK, DIPULIHKAN DAN DIKEMBALIKAN
6.146 Cukup jelas.
6.147 Pengolahan ulang terhadap produk antara atau produk ruahan hanya dapat dilakukan bila tersedia prosedur pengolahan ulang yang telah divalidasi. Lihat Butir 7.41 dan 7.42.
6.148 Otorisasi pelaksanaan pemulihan hendaklah diberikan berdasarkan analisis risiko dan bukti-bukti yang cukup bahwa produk pulihan memenuhi persyaratan mutu yang ditetapkan. Jumlah produk ruahan, produk antara atau sisa produk yang ditambahkan pada bets berikutnya hendaklah diperhatikan, dihitung secara teliti dan dibatasi jumlahnya agar mutu produk yang akan diperoleh tidak terpengaruh.
Prosedur penanganan produk yang akan dipulihkan dapat dibuat secara terpisah atau dicakup dalam prosedur pengolahan induk. Lihat contoh Protap Penanganan Produk Pulihan, Lampiran 6.148.
6.149 Cukup jelas.
6.150 Penambahan produk pulihan harus dicantumkan dalam Catatan Bets.
6.151 Suatu obat dapat dikemas ulang apabila obat tersebut memenuhi standar, spesifikasi dan karakteristik yang telah ditetapkan.
Suatu obat yang telah daluwarsa atau obat yang disimpan dengan kondisi penyimpanan yang tidak baik seperti pada suhu tinggi, kelembaban tinggi, terkena asap, wangi-wangian, atau karena musibah alam seperti kebakaran, kebanjiran, atau yang diragukan kondisi penyimpanan dan penanganannya tidak boleh dikemas ulang.
KARANTINA DAN PENYERAHAN PRODUK JADI
6.152 Produk jadi yang masih dalam status karantina hendaklah diberi label “Karantina“ dan tidak didistribusikan sebelum diluluskan oleh bagian Pemastian Mutu, lihat contoh Label Status Bahan Dan Produk, Lampiran 1 dalam Protap Penandaan, Lampiran 6.13.
6.153 Setiap penyerahan produk jadi dalam status karantina hendaklah disertai dengan surat penyerahan, lihat contoh Surat Penyerahan Produk Jadi, Lampiran 6.153a, serta dicatat di sistem persediaan produk jadi status karantina.
Produk jadi dalam status karantina ini hendaklah disimpan di daerah karantina yang terpisah secara fisik atau pada area yang sama untuk produk jadi yang telah diluluskan tetapi dipisah dan dikendalikan secara administratif.
Setelah diluluskan oleh bagian Pengawasan Mutu, produk jadi ini dapat dipindahkan ke daerah penyimpanan produk jadi dan dicatat di sistem persediaan produk jadi.
Tata-cara untuk penerimaan, penyimpanan dan pengiriman produk jadi hendaklah dibuat secara tertulis, lihat contoh Protap Penerimaan, Penyimpanan dan Penyerahan Produk Jadi, Lampiran 6.153b.
6.154 Cukup jelas.
6.155 Cukup jelas.
6.156 Cukup jelas.
6.157 Cukup jelas.
6.158 Lihat Butir 7.3.
6.159 Pemindahan ini bisa dilakukan secara fisik maupun secara administratif.
6.160 Lihat Butir 6.153.
CATATAN PENGENDALIAN PENGIRIMAN OBAT
6.161
s/d
6.164 Sistem distribusi hendaklah dibuat tertulis sehingga menjamin pelaksanaan prinsip Pertama Masuk-Pertama Keluar atau Pertama Daluwarsa-Pertama Keluar. Penyimpangan dari prinsip ini hendaklah mendapat persetujuan dari kepala bagian Pemastian Mutu. Lihat contoh Protap Penerimaan, Penyimpanan dan Penyerahan Produk Jadi, Lampiran 6.153b.
PENYIMPANAN BAHAN AWAL, BAHAN PENGEMAS, PRODUK ANTARA, PRODUK RUAHAN DAN PRODUK JADI
6.165 Sistem penyimpanan dapat dilakukan secara :
(a) Sistem Acak
Barang disimpan di atas palet di area penyimpanan (dapat berupa rak atau lantai) mana saja dalam satu ruangan. Tiap area penyimpanan hendaklah diberi nomor lokasi penyimpanan. Tiap palet hendaklah berisi satu jenis barang saja dan dari satu bets/lot. Untuk melaksanakan sistem acak, pada sistem persediaan dicatat juga nomor lokasi penyimpanan tiap barang. Lihat Butir 6.19 dan Butir 10.26.
(b) Sistem Kelompok
Pada sistem ini barang ditempatkan pada area penyimpanan berdasarkan jenis barang dan statusnya.
(c) Kombinasi dari Sistem Acak dan Sistem Kelompok
Sistem yang akan digunakan tergantung dari jumlah jenis barang yang akan disimpan, kapasitas gudang dan sistem pengendalian barang.
6.166 Cukup jelas.
6.167 Bahan yang mudah terbakar hendaklah disimpan di gudang khusus untuk bahan mudah terbakar yang letaknya terpisah sesuai dengan peraturan keselamatan kerja yang berlaku.
Sesuai dengan peraturan pemerintah yang berlaku bahan awal psikotropika, prekursor hendaklah disimpan di tempat terkunci dan kuncinya disimpan oleh penanggung jawab yang ditunjuk.
6.168 Kondisi penyimpanan obat dan bahan diperlakukan sama dengan kondisi penyimpanan bahan awal. Lihat Butir 6.31.
6.169 Cukup jelas, lihat contoh Catatan Pemantauan Lingkungan Ruang Penyimpanan, Lampiran 6.169.
6.170 Cukup jelas.
6.171 Kegiatan lain, misal produksi dan pengujian, hendaklah dilakukan di daerah terpisah dari gudang.
6.172 Cukup jelas.
6.173 Cukup jelas.
Penyimpanan Bahan Awal dan Bahan Pengemas
6.174 Cukup jelas.
6.175 Cukup jelas, lihat contoh Protap Penerimaan, Penyimpanan dan Penyerahan Bahan Awal, Lampiran 6.2a.
6.176 Cukup jelas.
6.177 Cukup jelas.
6.178 Untuk mencegah terjadinya penyalahgunaan atau kesalahan, maka bahan cetak hendaklah disimpan di dalam ruangan atau lemari terkunci.
6.179 Cukup jelas.
6.180 Lihat Butir 7.39.
Penyimpanan Produk Antara, Produk Ruahan dan Obat Jadi
6.181 Cukup jelas.
6.182 Cukup jelas.
6.183 Cukup jelas.
6.184 Cukup jelas.
PENGIRIMAN DAN PENGANGKUTAN
6.185 Bahan atau obat hendaklah ditempatkan dalam wadah yang sesuai dan cukup kuat untuk memastikan bahan atau obat tidak mengalami kerusakan fisik selama proses transportasi. Kondisi pengangkutan, misal suhu, hendaklah sesuai dengan yang tertera pada label.
6.186 Cukup jelas.
6.187 Suhu selama transportasi dapat dipantau dengan alat “electronical temperature recorder” yang ditempatkan di dalam dus (shipper = corrugated box) bersama-sama dengan produk jadi yang dikirimkan. Setelah sampai di tujuan, “electronical temperature recorder” tersebut dikirim kembali ke pabrik untuk dievaluasi.
6.188 Tiap pengiriman produk jadi hendaklah disertai dengan dokumen pengiriman produk jadi yang mencantumkan antara lain: nama sediaan, nomor bets, jumlah, tanggal pengiriman, nama dan alamat penerima. Pengiriman produk jadi hendaklah didokumentasikan untuk memudahkan penelusuran kembali bila ada keluhan dari pelanggan atau bilamana suatu obat harus ditarik dari peredaran. Lihat contoh Order Pengiriman, Lampiran 6.188.
6.189 Cukup jelas, lihat contoh Protap Pengiriman Obat Jadi, Lampiran 6.189.
6.190 Cukup jelas.
6.191 Lihat contoh Order Pengiriman, Lampiran 6.188.
6.192 Catatan yang mudah diakses akan memudahkan penelusuran kembali bilamana ada keluhan dari pelanggan atau bilamana obat harus ditarik dari peredaran.
BAB 7
|
UMUM
7.1
s/d
7.3 Cukup Jelas.
7.4 Manajer Pengawasan Mutu bertanggung jawab terhadap pelaksanaan validasi metoda analisis.
7.5 Dalam hal tertentu misalnya dalam pembuatan obat secara aseptis, personil produksi dapat melakukan pengambilan sampel, asalkan sudah diberikan pelatihan seperti yang tercantum pada butir 7.22
CARA BERLABORATORIUM PENGAWASAN MUTU YANG BAIK
7.6. Bangunan dan Fasilitas
a) Ukuran laboratorium dan tata ruang
Ukuran laboratorium ditentukan oleh jenis dan volume kegiatan, jumlah peralatan dan personil laboratorium. Sebagai pedoman, luas laboratorium dalam meter persegi sama dengan jumlah personil dikalikan 10 – 20.
Tata ruang laboratorium harus diatur sesuai dengan jenis kegiatan dan untuk mencegah kontaminasi. Ketentuan hendaklah dibuat untuk melakukan pengujian fisiko-kimia, biologi, mikrobiologi dan pengujian produk radioisotop di tempat khusus. Di samping itu tempat-tempat khusus berikut ini hendaklah tersedia dalam suatu laboratorium:
1. Ruang untuk instrumen
2. Tempat untuk menyimpan sampel yang akan diuji
3. Sampel hendaklah ditata dengan baik untuk menghindari campur baur untuk sampel yang belum diuji dengan sampel yang telah diuji.
4. Tempat penimbangan bahan uji
5. Untuk timbangan analitik hendaklah diletakkan diatas meja tahan getar dan ditempatkan di area dengan aliran udara serendah mungkin
6. Tempat penyimpanan pelarut dan pereaksi
7. Ruang penyimpanan sampel pertinggal (lokasi dapat di luar laboratorium)
Jarak antara meja kerja sekurang-kurangnya 1,2m.
Lihat Contoh Desain Tata Letak Ruang Laboratorium Pengawasan Mutu, Lampiran 3.36.
b) Limbah dan residu hendaklah ditampung dalam wadah yang tertutup rapat dan diberi tanda jelas yang menyatakan jenis dan penggolongan risiko limbah tersebut. Pemusnahan limbah dan residu hendaklah dilaksanakan tanpa menimbulkan pencemaran lingkungan.
Bahan beracun hendaklah disimpan dalam lemari yang terkunci. Bahan mudah terbakar disimpan dalam lemari khusus tahan api yang dibumikan.
c) Area laboratorium hendaklah terpisah secara fisik dari area produksi agar bebas dari sumber cemaran maupun getaran yang dapat berpengaruh terhadap hasil pengujian. Dianjurkan agar disediakan koridor yang lebarnya tidak kurang dari 2m untuk memisahkan area laboratorium dari area produksi, apabila keduanya berada di gedung yang sama.
Dalam suatu fasilitas pembuatan produk biologi, laboratorium hendaklah dalam bangunan khusus yang terpisah dari area produksi.
Laboratorium pengawasan-selama-proses akan lebih memudahkan apabila letaknya di area pemrosesan atau pengemasan dimana dilakukan pengujian fisik seperti penimbangan dan uji pemantauan lainnya secara periodik. Dalam hal itu tingkat kebersihan laboratorium pengawasan-selama-proses harus memenuhi persyaratan standar lingkungan area produksi yang bersangkutan.
d) Laboratorium fisiko-kimia, mikrobiologi, dan radioisotop hendaklah memiliki ruang tersendiri karena perbedaan jenis pengujian, peralatan dan bahan-bahan penguji yang terdapat di setiap laboratorium. Sistem tata udara di laboratorium hendaklah terpisah dengan sistem tata udara ruang produksi. Di dalam laboratorium mikrobiologi perlu disediakan meja kerja dengan aliran udara laminar di dalam suatu ruang bersih (Kelas D atau lebih tinggi). Untuk uji sterilitas, hendaklah disediakan ruang tersendiri dengan pengaliran udara melalui saringan HEPA dengan efisiensi 99,995 % (EN 779 dan EN 1822: H13 – H14). Lihat Butir 3.36.
Mengingat bahwa hewan merupakan sumber cemaran dan perlakuan khusus diperlukan untuk hewan percobaan, maka laboratorium biologi dan ruang hewan uji hendaklah terletak dalam ruang yang terpisah dengan sistim pengendali udara sendiri dan dilengkapi dengan ruang antara yang berfungsi sebagai ruang penyangga udara. Tempat pemeliharaan hewan hendaklah berada dalam bangunan terpisah.
e) Faktor eksternal lain yang perlu dipertimbangkan untuk ruang instrumen misalnya menghindari sinar matahari langsung pada instrumen untuk melindungi bagian yang sensitif dari instrumen serta menghindari terjadinya pembacaan yang salah.
f) Bahan konstruksi dan perabot yang dipakai di ruang laboratorium hendaklah tahan terhadap asam, alkali, dan zat kimia lain.
Ruang laboratorium hendaklah dilengkapi dengan unit penanganan udara khusus untuk mengkondisikan suhu 20 – 28ºC. Untuk instrumen yang sensitif misal KCKT, inframerah, suhu dan kelembaban relatif di ruang tersebut hendaklah dijaga pada 20 – 28ºC dan kelembaban 60 – 90%.
Jika diperlukan, sistem ventilasi hendaklah mampu menarik uap, gas, asap, debu, bau dan panas dengan segera. Dalam hal ini, hendaklah disediakan lemari asam yang dilengkapi sistem penghisap udara untuk menghindari penetrasi asap toksis ke area laboratorium. Kecepatan penghisap udara minimum 15 meter kubik udara per jam per meter kubik volume lemari asam dan kecepatan aliran udara pada permukaan pipa penghisap (face velocity) 0,4 – 0,6 meter per detik. Kecepatan aliran udara hendaklah dipantau dan dicatat secara periodik.
g) Dalam pemasangan instalasi pipa listrik, air, gas, udara vakum dan udara tekan hendaklah diperhatikan kemudahan untuk pemeliharaan dan perbaikan, misalnya dengan cara memasang dalam panel yang mudah dibuka atau menempelkannya pada bagian luar dinding. Instalasi pipa hendaklah diberi kode atau warna yang berbeda, misalnya hijau muda untuk pipa aqua demineralisata dan abu-abu untuk pipa nitrogen serta tanda panah pada pipa untuk menunjukkan arah aliran di dalamnya, sehingga kekeliruan dalam pemakaian atau perbaikan saluran dapat dihindarkan. Lihat Contoh Penandaan Pipa, Lampiran 4.15.
7.7. Personil
a) Oleh karena pengawasan mutu meliputi semua fungsi analisa yang dilakukan di laboratorium, penanganannya diserahkan kepada personil laboratorium yang memiliki keahlian khusus antara lain di bidang farmasi, kimia atau biologi/mikrobiologi serta memiliki pengalaman dan pelatihan yang cukup di bidang tugasnya, untuk menjamin kebenaran dan ketepatan hasil uji yang diperoleh.
Catatan kualifikasi masing-masing personil laboratorium hendaklah dibuat dan mencakup :
· Pendidikan dan pelatihan termasuk pelatihan internal;
· Tempat serta lamanya pendidikan dan pelatihan;
· Gelar, ijasah serta sertifikat yang dimiliki; dan
· Kualifikasi khusus seperti keahlian dalam instrumentasi, analisis mikrobiologi, pemeliharaan hewan, dan lain-lain.
Tugas dan tanggung jawab hendaklah diberitahukan kepada setiap personil dan tertuang sebagai uraian tugas tertulis.
b) Cukup jelas. Lihat Contoh:
· Protap Penggunaan Alat Pelindung Diri (APD), Lampiran 7.7b dan
· Pakaian Pelindung Sesuai dengan Ruang Kelas Kebersihan, Lampiran 5.1.
7.8. Peralatan
a) Cukup Jelas.
b) Cukup Jelas. Lihat Contoh:
· Protap Pengoperasian pH Meter, Lampiran 7.8b.1
· Protap Pengoperasian Alat Uji Kekerasan Tablet, Lampiran 7.8b.2.
Lihat Contoh:
· Program Kalibrasi Instrumen Laboratorium, Lampiran 7.8c.1;
· Protap Kalibrasi Polarimeter, Lampiran 7.8c.2;
d) Lihat Contoh Label Status Peralatan, Lampiran 7.8d
e) Lihat Contoh
· Pancuran Air Keselamatan (safety shower), Lampiran 7.8f.1
· Pembasuh Mata, Lampiran 7.8f.2
· Protap Penggunaan dan Pemeliharaan Alat Pembasuh Mata,
Lampiran 7.8f.3
7.9. Cukup Jelas
7.10. Pereaksi dan Media Perbenihan
a) Cukup Jelas
b) Cukup Jelas, Lihat Contoh
· Catatan Pembuatan Larutan Pereaksi dan Media Perbenihan,
Lampiran 7.10b.1
· Label Wadah Larutan Titer, Lampiran 7.10b.2
· Label Wadah Larutan Pereaksi dan Media Perbenihan, Lampiran 7.10b.3
c) Cukup Jelas
7.11 Baku Pembanding terdiri dari baku pembanding primer, sekunder dan baku pembanding kerja.
Baku Pembanding kerja adalah baku pembanding minimal yang harus digunakan dalam pengujian bahan aktif maupun obat jadi. Baku pembanding kerja dapat dibuat dari bahan aktif yang telah dibakukan terhadap baku pembanding primer atau sekunder.
Pembakuan Baku Pembanding Kerja dilakukan terhadap Baku Pembanding primer atau Sekunder, minimal dilakukan 6 kali pengulangan dengan RSD < 2%.
Lihat contoh:
· Protap Pembuatan Baku Pembanding Sekunder, Lampiran 7.11.1
· Label Baku Pembanding, Lampiran 7.11.2
7.12 Hendaklah tanggal penerimaan dan pertama kali wadah dibuka dicantumkan pada tiap wadah bahan yang digunakan untuk kegiatan pengujian (misalnya pereaksi dan baku pembanding).
7.13 Cukup Jelas
7.14 Cukup Jelas.
PENGAWASAN BAHAN AWAL, PRODUK ANTARA, PRODUK RUAHAN DAN PRODUK JADI
7.15 Cukup Jelas
DOKUMENTASI
7.17
s/d
7.20 Cukup Jelas
SAMPLING
7.21
Lihat Contoh Protap Pengambilan Sampel Bahan Awal, Lampiran 7.23.
7.22 Cukup Jelas.
Bahan Awal
7.23 Pengambilan sampel bahan awal hendaklah dilakukan menurut pola di bawah ini:
· Pola n: hanya jika bahan yang akan diambil sampelnya diperkirakan homogen dan diperoleh dari pemasok yang disetujui. Sampel dapat diambil dari bagian manapun dari wadah (umumnya dari lapisan atas)
di mana n = √ N + 1
n = jumlah wadah yang dibuka
N = jumlah wadah yang diterima
· Pola p: jika bahan homogen, diterima dari pemasok yang disetujui dan tujuan utama adalah untuk pengujian identitas.
di mana p = 0.4 √ N
N = jumlah wadah yang diterima/diambil sampel
p = jumlah sampel yang diambil berdasarkan pembulatan ke atas
· Pola r: jika bahan
- diperkirakan tidak homogen dan/atau
- diterima dari pemasok yang belum dikualifikasi.
Pola r dapat digunakan untuk produk herbal yang digunakan sebagai bahan awal.
di mana r = 1.5 √N:
N = jumlah wadah yang diterima/diambil sampel
r = jumlah sampel yang diambil berdasarkan pembulatan ke atas
Sampel untuk pemeriksaan identitas bahan aktif hendaklah diambil dari tiap wadah, untuk eksipien dapat diambil dari sejumlah tertentu wadah apabila sudah dilakukan pengkajian terhadap pemasok sesuai dengan butir 7.14.
7.24 Cukup Jelas
Bahan Pengemas
7.25 Pengambilan sampel bahan pengemas hendaklah dilakukan menurut Pola Pengambilan Sampel Bahan Pengemas, Lampiran 7.25
Kegiatan Pengambilan Sampel
7.26 Untuk menghindari terjadinya pencemaran dan pencemaran silang terhadap bahan yang diambil sampelnya maka:
· Pengambilan sampel bahan baku hendaklah minimal dilakukan di dalam ruang pengambilan sampel yang setara dengan kelas kebersihan jenis produk yang diproduksi dan dilengkapi dengan dust extractor.
· Ruang pengambilan sampel hendaklah dilengkapi dengan laminar air flow (LAF).
7.27 Cukup Jelas
7.28 Cukup jelas.
7.29 Cukup Jelas. Lihat Contoh Penandaan Wadah Sampel, Lampiran 7.29.
7.30 Pembilasan akhir alat pengambil sampel hendaklah menggunakan air murni. Alat yang sudah dibersihkan harus mempunyai batas waktu penyimpanan dan harus dibersihkan kembali jika batas waktu tersebut terlampaui. Hendaklah dilakukan validasi terhadap batas waktu penyimpanan sesuai dengan validasi batas waktu penyimpanan alat produksi, Lihat Butir 12.37.
7.31 Untuk bahan yang sulit dibersihkan, berbahaya dan berpotensi tinggi sebaiknya disediakan alat pengambil sampel tersendiri.
7.32 Cukup Jelas.
PERSYARATAN PENGUJIAN
7.33 Parameter pengujian tertentu untuk bahan awal yang telah disetujui pada saat pemberian izin edar dapat dikurangi bila hasil tren seluruh parameter yang diuji telah memenuhi syarat, minimal pada 10 bets berbeda yang diterima berurutan dari pemasok (pabrik pembuat) yang sama dan memenuhi minimal 2 kriteria berikut ini:
· dapat dipastikan dan diketahui pabrik pembuatnya (bukan distributor atau broker) atau adanya jaminan dari distributor atau broker yang menyatakan bahwa bahan baku tersebut berasal dari pabrik pembuat yang sama;
· pabrik pembuat sudah diaudit secara rutin oleh industri pengguna atau organisasi professional dalam bidang mutu dan memenuhi syarat CPOB;
· pabrik pembuat sudah pernah diaudit oleh industri farmasi lain yang dapat dijadikan rujukan; dan
· mempunyai certificate of suitability yang diterbitkan oleh badan otoritas dari negara terkait dari pabrik pembuat atau memeroleh persetujuan dari OPO.
Minimal 1 kali setahun hendaklah dilakukan uji lengkap.
Bila terjadi kegagalan pemenuhan spesifikasi hendaklah dilakukan pengujian lengkap tiap bets bahan hingga diperoleh keyakinan terhadap pemasok melalui pengkajian tren hasil parameter uji.
Parameter pengujian yang tidak boleh dikurangi adalah:
· Pemerian;
· Identifikasi sesuai dengan monografinya;
· Penetapan kadar/potensi untuk bahan aktif atau zat tertentu tetapi metode pengujiannya dapat diganti antara lain:
- pada proses metode pengujian ukuran partikel, kadar bahan aktif, homogenitas, kadar air antara lain menggunakan Near-Infrared Spectrophotometry (NIR) dan Raman spectroscopy;
- uji logam berat, vitamin dan mineral dengan Atomic Absorption Spectroscopy (AAS).
7.34 Cukup Jelas
7.35 Pengujian produk antara atau produk ruahan dan persetujuan untuk pemeriksaan setelah produksi kritis atau produk tersimpan lama dapat dilakukan secara pararel dengan proses pengemasan asalkan proses tersebut sudah di validasi termasuk lama penyimpanan produk ruahan.
7.36 Parameter pengujian tertentu untuk produk jadi yang telah disetujui pada saat pemberian izin edar dapat dikurangi bila hasil tren seluruh parameter yang diuji telah memenuhi syarat, minimal pada 10 bets yang diproduksi berurutan dan memenuhi kriteria berikut ini:
· Proses pembuatan sudah divalidasi
· Uji stabilitas memenuhi syarat
· Tersedia data validasi retrospektif atau peninjauan produk tahunan
Parameter pengujian yang tidak boleh dikurangi adalah :
· Pemerian
· Identifikasi sesuai dengan monografinya
· Uji disolusi
· Kadar bahan aktif
· Degradasi
· Uji sterilitas (untuk produk steril)
Sebagai contoh, untuk sediaan tablet parameter pemeriksaan selama proses yang dapat dikurangi antara lain keseragaman bobot, kekerasan, kerenyahan dan waktu hancur. Contoh lain adalah:
· pada proses metode pengujian ukuran partikel, homogenitas, kadar air antara lain menggunakan near-infrared spectrometry (NIR) dan Raman spectroscopy;
· uji logam berat, vitamin dan mineral dengan Atomic Absorption Spectroscopy (AAS).
Minimal 1 kali setahun harus tetap dilakukan uji lengkap.
Bila terjadi kegagalan pemenuhan spesifikasi hendaklah dilakukan pengujian lengkap tiap bets produk jadi hingga diperoleh keyakinan terhadap proses produksi melalui pengkajian tren hasil parameter uji.
Pengurangan parameter pengujian harus dilaporkan dan mendapat persetujuan Otoritas Pengawasan Obat (OPO) sebelum dilaksanakan.
Untuk mendapatkan persetujuan OPO, dokumen yang harus disampaikan antara lain:
· Data dan kajian hasil pengujian produk 10 bets berurutan
· Laporan validasi proses
· Laporan uji stabilitas
· Pengkajian risiko terhadap pengurangan parameter pengujian
· Laporan Pengkajian Produk Tahunan
Pengendalian Lingkungan
7.37. a) Jumlah sampel, spesifikasi dan metode pengujian untuk pemeriksaan mutu air hendaklah mengikuti persyaratan Farmakope yang berlaku atau persyaratan yang dijadikan acuan oleh industri farmasi yang bersangkutan.
b) Lihat Contoh:
· Protap Pemantauan Lingkungan Produksi dengan Cawan Papar,
Lampiran 7.37b.1
· Protap Pengujian Cara Apus, Lampiran 7.37b.2
· Program Pemantauan Lingkungan Terhadap Mikroba, Lampiran 7.37b.3.
c)
s/d
d) Cukup Jelas
Pengawasan-Selama-Proses
7.38 Cukup Jelas.
Pengujian Ulang Bahan yang Diluluskan
7.39 Batas waktu uji ulang bahan awal yang tidak mempunyai shelf life dan tidak dinyatakan dalam Sertifikat Analisisnya, hendaklah ditetapkan berdasarkan pengetahuan tentang kestabilan bahan tersebut. Untuk eksipien umumnya dapat dilakukan setiap 2 (dua) tahun kecuali apabila eksipien tersebut tidak stabil misalnya: benzyl alcohol dilakukan setiap 6 (enam) bulan karena mudah teroksidasi menjadi benzaldehyde.
Untuk produk antara dan produk ruahan, batas waktu penyimpanan sebelum proses selanjutnya hendaklah ditentukan berdasarkan validasi, sedangkan untuk produk jadi batas waktu daluarsa ditetapkan berdasarkan uji stabilitas.
7.40 Cukup Jelas
Pengolahan Ulang
7.41 Untuk melihat apakah terjadi perubahan mutu setelah pengolahan ulang, misal penambahan waktu pengeringan, penambahan waktu granulasi hendaklah dilakukan pengujian tambahan antara lain untuk memeriksa hasil degradasi.
7.42 Apabila akan dilakukan pengolahan ulang, misal produk jadi dikeluarkan dari pengemas dan/atau produk ruahan dihancurkan, digranulasi ulang dan dicetak kembali, hendaklah dipersiapkan dahulu analisis risiko yang mencakup antara lain sumber penyimpangan, tindakan perbaikan yang akan dilakukan, tindakan penanganan produk dalam rangka menghilangkan/mengurangi risiko terhadap pemakai. Pada proses pengolahan ulang hendaklah dilaksanakan pengujian sebagaimana dilakukan pada validasi proses dan uji stabilitas terhadap produk jadinya minimal 3 bulan pada kondisi yang dipercepat apabila penyimpangan tersebut menyangkut kadar, keseragaman kandungan, hasil urai, disolusi sebelum produk tersebut diluluskan.
Evaluasi Pengawasan Mutu terhadap Prosedur Produksi
7.43 Cukup Jelas.
7.44 Cukup Jelas.
Studi Stabilitas
7.45
dan
7.46 Cukup jelas.
7.47 a) Lihat ASEAN Guideline on Stability Study of Drug Product. dan Guidelines resmi lainnya misal ICH, terutama alur pengambilan keputusan untuk penetapan daluwarsa produk.
b) Cukup jelas.
c) Jenis perubahan lihat lampiran contoh Perubahan Kecil, Perubahan Besar dan Uji Stabilitas, Lampiran 7.47.
d) Cukup jelas.
e) Studi stabilitas produk beredar:
· Uji stabilitas untuk produk yang beredar hendaklah dilakukan minimal 1 bets dalam 1 tahun, asalkan didukung data pengkajian produk tahunan (annual product review) atau validasi retrospektif.
· Penyimpanan sampel dilakukan pada suhu kamar atau suhu yang dipersyaratkan dan harus dimonitor.
· Periode pemeriksaan: 12, 24, 36 bulan atau sampai dengan masa daluwarsa tercapai.
Apabila produk tersebut direkonstitusi, hendaklah dilakukan in-use stability study di periode akhir atau pada daluwarsa produk tersebut.
· Parameter pengujian Lihat ASEAN Guideline on Stability Study of Drug Product.
|
PRINSIP
Dengan melakukan inspeksi diri dapat diketahui kekurangan atas pemenuhan CPOB, baik yang kritis, yang berdampak besar maupun yang berdampak kecil. Penilaian terhadap kekurangan atas pemenuhan CPOB sebagai berikut :
| Tingkat Kekritisan | Terdiri dari antara lain
|
| Kritis (C) Adalah kekurangan yang memengaruhi mutu obat dan dapat mengakibatkan reaksi fatal terhadap kesehatan konsumen sampai kematian. | · Pencemaran silang bahan atau produk. · Produk steril diletakkan terbuka di daerah non-aseptis. · Air Murni atau Air untuk Injeksi tercemar. · Salah penandaan. · Karyawan yang belum terlatih bekerja di daerah pengisian steril/aseptis. |
| Berdampak Besar (M) Adalah kekurangan yang memengaruhi mutu obat tetapi tidak berdampak fatal terhadap kesehatan konsumen | · Peralatan ukur utama tidak dikalibrasi atau di luar batas kalibrasi. · Penyimpangan dalam proses tidak didokumentasi dengan benar. · Ketidaklengkapan pengisian catatan bets. · Tidak dilakukan inspeksi terhadap perusahaan penerima kontrak. |
| Berdampak Kecil (m) Adalah kekurangan yang kecil pengaruhnya terhadap mutu obat dan tidak berdampak terhadap kesehatan konsumen. | · Pembersihan gudang tidak sesuai jadwal. · Permukaan dinding retak. · Catatan ditulis dengan pinsil. · Seragam kerja tidak dipakai secara benar. |
Inspeksi diri hendaklah dilakukan secara independen (ditunjuk secara tertulis dan tidak dipengaruhi atasan) oleh orang yang kompeten, yaitu terkualifikasi dan mempunyai pengalaman yang memadai dalam melakukan inspeksi diri.
Inspeksi diri dapat dilakukan sendiri oleh pihak perusahaan dengan membentuk suatu tim atau oleh konsultan yang independen dari luar perusahaan.
Di samping menemukan kekurangan dan kelemahan lain juga harus ditetapkan cara yang efektif untuk pencegahan terjadi lagi hal yang sama dan untuk melakukan perbaikan.
Untuk inspeksi diri perlu dibuat suatu Protap. Lihat Contoh Protap Inspeksi Diri, Lampiran 8.
ASPEK UNTUK INSPEKSI DIRI
8.1. Untuk memperoleh standar inspeksi diri hendaklah dibuat daftar periksa selengkap mungkin sebagai rujukan untuk tim inspeksi diri dalam melaksanakan tugasnya.
Daftar periksa ini hendaklah meliputi semua aspek yang disertai sejumlah pertanyaan yang bersifat umum untuk masing-masing kategori.
Lihat Contoh Daftar Periksa Inspeksi Diri, Lampiran 8.1.
Daftar periksa ini hendaklah diperbaharui secara berkala agar selalu mengikuti dan meliputi perubahan, peraturan pemerintah dan kebijakan perusahaan.
Daftar periksa ini hendaklah disusun sedemikian rupa sesuai dengan program pembuatan obat yang ada di industri farmasi agar mudah digunakan oleh tim inspeksi diri.
TIM INSPEKSI DIRI
8.2 Anggota tim hendaklah dipilih dari bagian-bagian produksi, pengawasan mutu, pemastian mutu, penelitian & pengembangan dan teknik. Jumlah anggota tim tergantung dari kebutuhan masing-masing perusahaan, sedikitnya terdiri dari 3 (tiga) orang. Tim ini hendaklah terdiri dari tenaga teknis yang kompeten dan memiliki kesadaran tinggi akan pentingnya pemastian mutu dalam kegiatan pembuatan obat.
Sebaiknya tim mengikutsertakan seorang dari manajemen perusahaan yang bila perlu dapat mengambil keputusan langsung di tempat dan mempunyai kewenangan untuk memerintahkan segera dilakukan perbaikan yang perlu.
Anggota tim dapat ditunjuk dari dalam atau dari luar perusahaan. Konsultan dari luar dapat juga masuk dalam tim untuk memperoleh penilaian yang lebih objektif tentang kegiatan perusahaan.
CAKUPAN DAN FREKUENSI INSPEKSI DIRI
8.3 Inspeksi diri hendaklah mencakup semua bagian yaitu pemastian mutu, produksi, pengawasan mutu, teknik dan gudang (termasuk gudang obat jadi, bahan baku dan bahan pengemas). Perusahaan hendaklah menyiapkan program inspeksi diri yang mencakup frekuensi. Lihat Contoh Program Inspeksi Diri, Lampiran 8.3. Untuk bagian tertentu dari produksi misalnya pembuatan produk steril hendaklah dilakukan inspeksi diri lebih sering sesuai dengan kebutuhan.
LAPORAN INSPEKSI DIRI
8.4 Dalam menjalankan inspeksi diri tim hendaklah berfokus pada tujuan yaitu untuk menemukan hal yang memerlukan perbaikan dan bukan untuk mencari kesalahan seseorang. Laporan hendaklah mencakup semua temuan dan tingkat kekurangan terhadap temuan serta saran tindakan perbaikan dengan tetap mempertimbangkan tingkat kekurangan untuk menentukan prioritas pelaksanaan perbaikan.
Laporan ini disampaikan kepada masing-masing kepala bagian Pemastian Mutu, Produksi, Pengawasan Mutu, Teknik dan pimpinan perusahaan.
Lihat Contoh Laporan Inspeksi Diri, Lampiran 8.4.
TINDAK LANJUT
8.5 Cukup jelas, lihat Contoh Laporan Inspeksi Diri, Lampiran 8.4.
AUDIT MUTU
8.6 Cukup jelas, lihat Contoh Daftar Periksa Audit Mutu, Lampiran 8.6.
AUDIT DAN PERSETUJUAN PEMASOK
8.7 Hendaklah dibuat prosedur tetap untuk mengaudit pemasok bahan awal dan pemasok bahan pengemas. Protap ini hendaklah mencakup daftar periksa (lihat Butir 8.9), program yang meliputi frekuensi audit, evaluasi dan tim audit yang melibatkan bagian Pembelian, bagian Pengawasan Mutu, bagian Produksi yang dipimpin oleh kepala bagian Pemastian Mutu. Persetujuan hendaklah diberikan oleh kepala bagian Pemastian Mutu.
8.8 Cukup jelas.
8.9 Hasil audit hendaklah dievaluasi untuk memastikan bahwa pemasok masuk ke dalam kategori pemasok yang disetujui. Untuk melakukan penilaian terhadap pemasok, hendaklah dibuat daftar periksa. Lihat Contoh Daftar Periksa Penilaian Terhadap Pemasok, Lampiran 8.9.
8.10 Lihat Butir 8.7.