Total Pengunjung Blog
Buku & Sastra Made Gue
All about CPOB
- download CPOB 2006 dan PCPOB 2009
- "catatan" dokumentasi berdasar CPOB
- Pets control berdasar CPOB 2006 serta implementasinya
- inspeksi diri dan audit berdasar CPOB 2006
- dasar - dasar kalibrasi alat
- Apa itu retain sampel BB dan produk jadi serta ongoing stabiliti?
- water treatment for pharmaceutical use
- Berbagai bentuk perawatan mesin industri farmasi dan pengertian downtime
- Apa itu retain sampel BB dan produk jadi serta ongoing stabiliti?
- Alat pengatur tekanan udara (magnehelic)
- instalasi pengolahan air limbah with aerob system
- Master requirment planning
- master production scheduling
- Cleaning validation
- 10 prinsip CPOB
- Validasi proses
- HVAC (Heating ventilation air conditioning
- water treatment in pharmaceutical industrion
- tata ruang industri farmasi beta laktam production & non betalaktam
- stability studi?
Penelitian & Kuliah
- Tips hemat dalam penelitian
- kristalisasi sederhana
- pelarut murni, perlukah untuk penelitian ?
- Cara memurnikan sampel yang jumlahnya sedikit ?
- Mendaur ulang silika bekas kromatografi kolom
- cara memilih hewan uji untuk penelitian
- Agar tak menjadi plagiat
- cara memilih solven untuk fase gerak KLT
- Pola data statistika yang sering di jumpai difarmasi
- tips mencari referensi ilmiah untuk mengerjakan tugas akhir
- Tutorial ms.word, mumudahkan menulis skirpsi (membuat daftar isi, page number, daftar pustaka
- Informasi seputar Beasiswa unggulan dan tips agar diterima
- Berbagai macam judul buku farmasi untuk referensi
- Cara download gratis jurnal berbayar maupun ebook
Arsip Blog
- 2017 (5)
- 2016 (3)
- 2015 (4)
- 2014 (8)
- 2013 (17)
- 2012 (71)
-
2011
(151)
- Desember(9)
- November(6)
- Oktober(17)
-
September(36)
- Penemuan Dan Pengembangan Obat Berbasis Farmakolog...
- Target Aksi Obat dan Contohnya…(Farmakologi moleku...
- Download CPOB 2006 & Petunjuk CPOB 2009 beserta La...
- Tak mau aku meminangmu hanya dengan basmallah….!(m...
- Preparation Sampel (Kuliah II analisis Farmasi Pro...
- dari DNA hingga Analisis Sidik Jari.(Biomol pertem...
- Kenapa Kadar glukosa dalam darah bisa merangsang p...
- Modifikasi Kimia dan Evaluasi Biologi Senyawa-seny...
- DOKUMENTASI
- Pets Control (CPOB 2006 & Petunjuk serta implement...
- INSPEKSI DIRI DAN AUDIT (CPOB 2006 dan Petunjuk CP...
- KALIBRASI ALAT
- RETAIN SAMPEL BAHAN BAKU DAN PRODUK JADI INDUSTRI ...
- Water for Pharmaceutical Use / Air untuk Industri ...
- Berbagai Bentuk Perawatan (Maintenance) Mesin Indu...
- NUCLEAR MAGNETIC RESONANCE (NMR) SPECTROSCOPY = SP...
- BAB III. BANGUNAN DAN FASILITAS
- BAB IV. PERALATAN
- BAB V. SANITASI DAN HIGIENE
- BAB VI. PRODUKSI
- BAB VII. PENGAWASAN MUTU
- BAB VIII. INSPEKSI DIRI DAN AUDIT MUTU
- BAB 9. PENANGANAN KELUHAN TERHADAP PRODUK, PENARIK...
- BAB 11. PEMBUATAN DAN ANALISIS BERDASARKAN KONTRAK
- BAB 12. KUALIFIKASI DAN VALIDASI
- BAB II. PERSONALIA
- BAB 1. MANAGEMENT MUTU
- Kenapa Orang Diabetes itu lapar terus??Padahal ser...
- Cara Pembuatan Proposal Penelitian Part 1 (Metode ...
- NUCLEAR MAGNETIC RESONANCE (NMR) SPECTROSCOPY = SP...
- Struktur & Fungsi DNA, RNA, dan Protein (Prof. Sud...
- PANDUAN PENULISAN PROGRAM KREATIVITAS MAHASISWA (...
- Hasil Rapat Halal Bihalal Online KOPI Tanggal 9 Se...
- APA ITU KOPI??
- ALAT PENGATUR TEKANAN UDARA (Magnehelic®)/ Differe...
- IPAL (Instalasi Pengolahan Air Limbah) With Aerob ...
- Agustus(5)
- Juli(2)
- Juni(8)
- Mei(14)
- April(19)
- Maret(16)
- Februari(9)
- Januari(10)
- 2010 (70)
- 2009 (43)
- 2008 (4)
Daftar ISI
- DETERJEN (9)
- KOPI (24)
- PENELITIAN (16)
- PERISAI DIRI (12)
- PRIBADIKU (38)
- Sastra (98)
- Tips (24)
- computer and software (5)
- creative (18)
- dari blog friensdster (32)
- kuliah and buku (31)
- my BOOK (5)
- pascasarjana (43)
- profesi (45)
Pengikut
Popular Posts
-
Dear temen…kali ini andy lagi di tugasi oleh dosen untuk menulis 50 bahasa latin, gara =gara pretest andy g memenuhi kualifikasi.hehehe…...
-
Bagan alur ada di bawah….andy tampilkan di awal tulisan, agar nanti setelah membaca bagan bisa lebih paham.
-
PEMBALUT Pembalut tipis/plester of paris, sebelum pasien diberi pembalut gips, maka bagian tubuh tersebut diberi lapisan kapas gips yan...
-
Nama panjangku, Andy Eko wibowo, lahir pada tanggal 2 Juni 1988. Ayah bernama Dwi Yanto, dan Ibu bernama Retno Asih suminiati. Mempunyai dua...
-
Dear teman…..dear kawan-kawan sejawat farmasi dan kawan-kawan tercinta…meninjau kebutuhan teman-teman profesi terutama untuk yang angka...
-
Dear kawan kawan……..kali ini saya akan membagi pengalaman bagaimana MUDAHNYA mendapatkan beasiswa unggulan!!! sebelumnya, saya akan memberi...
-
Dear kawan…… Kali ini kita akan membahas mengenai bagaimana memilih fase gerak untuk kromatografi lapis tipis. Memilih solven sebagai ...
-
Dalam sebuah karya ilmiah baik itu sebuah penelitian maupun karya tulis tentunya para peneliti harus memiliki sumber referensi. Sumber refer...
-
Pada petunjuk CPOB 2009 Bab Bagunan dan Fasilitas, disebutkan bahwa untuk mencegah kontamination silang ( cross contamination) hendaklah dia...
-
sebelum menginjak ke pelayanan obat tanpa resep kita harus tahu terlebih dahulu apa itu obat tanpa resep??? klo obat dengan resep i...
Sesuai dengan namanya, NMR berhubungan dengan sifat magnet dari inti atom.
Dari pernyataan tersebut maka timbul pertanyaan, Kenapa Inti atom dapat bersifat magnet?
Untuk menjelaskan hal tersebut, mari kita bahas dari konsep dasarnya.
Spektroskopi NMR pada dasarnya merupakan spektroskopi absorbsi, apabila UV mengabsorbsi energi pada panjang gelombang UV-VIS sehingga terjadi transisi elektron, IR adanya transisi vibrasional, maka dalam NMR, sampel pada kondisi tertentu akan mengabsorbsi radiasi elektromagnetik daerah radio, pada frekuensi –frekuensi yang tergantung sifat – sifat sampel. Nah….jadi pada sampel yang diberi radiasi elektromangetik daerah radio tersebutlah yang akan muncul berbagai frekuensi puncak absorbsi yang apabila di plot versus intensitas puncak akan memberikan suatu spektrum NMR. dengan catatan sampel pada kondisi tertentu.
Kondisi tertentu seperti apakah itu? Yang membuat Kondisisi tertentu tersebut bberkaitan dengan spin inti. apa itu spin inti?
Spin Inti
Setiap inti atom bermuatan dimana pada kebanyakan inti, muatan bergerak (berputar) mengelilingi inti pada sumbu inti tersebut. Perputaran muatan inti ini akan menimbulkan dipol magnetik sepanjang sumbu inti dengan momen magnetik inti sebesar mikro. Sehingga yang terjadi, pada inti tertentu akan timbul sifat magnet (bersifat magnetik) akibat adanya dipol magnetik tersebut namun ada juga inti yang dipol magnetiknya hilang karena terjadi peristiwa saling meniadakan.
Inti tertentu seperti apa yang dapat menimbulkan sifat magnet dan inti seperti apa yang dipol magnetiknya hilang?
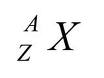
Inti tertentu yang menimbulkan sifat magnet adalah inti yang memiliki nomor atom gasal, nomor massa gasal atau keduanya gasal. Sedangkan yang dipol magnetiknya saling meniadakan dan tidak menimbulkan sifat magnet adalah inti yang memiliki nomor atom dan nomor massa genap.
inilah yang menyebabkan mengapa inti atom bisa bersifat magnetik.
Muatan yang berputar tersebut memiliki momentum sudut yang sering disebut bilangan Kuantum spin ( I ). Bilangan Kuantum spin ini merupakan resultan dari spin yang dimiliki oleh setiap proton dan netron dimana setiap proton dan netron mempunyai spinnya sendiri. Jadi, apabila harga I=0, maka artinya inti tidak memiliki spin sehingga tidak ada resultan dari spin. Hal ini karena jumlah proton genap dan jumlah netron genap. Harga dari I adalah 0, 1/2, 1,3/2, 2, 5/2, dan seterusnya. Jika jumlah proton dan netron ganjil maka harga dari I adalah 1/2;3/2;5/2. Jika jumlah salah satu proton atau netron genap maka nilai I 1,2,3 dst.
Bilangan kuantum spin dan kelimpahannya di alam dari beberapa inti atom
| Isotope | I | Natural abundance | Isotope | I | Natural abundance |
| 1H | 1/2 | 99,985 | 18O | 0 | 0,200 |
| 2H | 1 | 0,015 | 19F | 1/2 | 100 |
| 12C | 0 | 98,90 | 31P | 1/2 | 100 |
| 13C | 1/2 | 1,10 | 32S | 0 | 95,03 |
| 14N | 1 | 99,635 | 33S | 3/2 | 0,75 |
| 15N | 1/2 | 0,367 | 34S | 0 | 4,21 |
| 16O | 0 | 99,762 | 35Cl | 3/2 | 75,77 |
| 17O | 5/2 | 0,038 | 37Cl | 3/2 | 24,23 |
Nah..hidrogen dengan nomer massa 1 yang di alam sangat melimpah lah yang lebih digunakan HNMR. meskipun demikian Ditrium (H2) yang sediaan nya sedikit pun nanti juga berguna…tuh…lihat, carbon 12, di alam sangat melimpah, namun tidak ada CNRM carbon 12, karena I nya nol.tapi adanya CNMR carbon 13.
Kita lanjut ya…gimana atom – atom dengan I pecahan dapat terdeteksi di NMR?
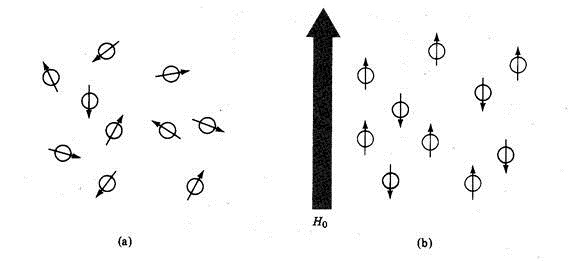
Nah…atom – atom yang bersifat magnetik apabila dalam kondisi normal (tidak dikenai medan magnetik eksternal), dia akan memiliki spin random dan masing – masing atom memiliki energi yang sama (liat gambar a).
Akan tetapi, atom – atom yang diberi medan magnetik eksternal (sering disimbolkan sebagai Ho atau Bo), maka tingkatan spin yang tadinya random berubah. Untuk proton dengan harga I =1/2, dia akan memiliki dua orentasi spin. (cara ngetung jumlah oreientasi spinnya dengan rumus 2 I + 1, misalnya untuk C13 yang I nya 1/2, maka jumlah orientasi spinnya 2 x (1/2)+ 1 sama dengan 2 orentasi. Begitu pula H1 yang I nya juga setengah.).
Kemana arah orientasi spin tersebut??? yakni searah dengan medan magnet eksternal dan berlawanan arah dengan medan magnet eksternal (gambar b). Dengan adanya medan magnet eksternal ini, energi dari spin ini menjadi tidak sama, ada yang melawan medan magnet eksternal memiliki energi yang lebih besar daripada spin yang searah dengan medan magnet eksternal. Untuk spin yang searah dengan medan magnet eksternal Bo di simbolkan dengan +1/2, sedangkan untuk yang berlawanan arah –1/2.

jawabnya adalah tergantung dari besar medang magnet eksternal yang diberikan (strength of applied field, Bo).
Nah..inilah jawaban mengapa NMR di LIPI, Surabaya, dan MIPA UGM hasil NMR nya “berbeda” jika berdasarkan frekuensi absorbsi.
Berapa beda tingkat energi yang dikenai Bo :
Delta E = h gama Bo/2phi
Dari persamaan tersebut terlihat bahwa perbedaan energi antara dua tingkatan spin tersebut tergantung pada kekuatan medan magnet eksternal, Bo. Semakin besar Bo yang dikenakan ke atom, maka semakin besar pula delta energinya. gama adalah rasio magnetogyric yang besarnya tergantung macam inti. jadi inti satu dengan inti atom lainnya berbeda, misal H1 dengan H2 memiliki perbedaan gama. Jadi delta E dipengaruhi gama, dan Bo.
Lantas kapan fenomena NMR bisa terjadi? maksudnya, sinyal yang ada dispektra bisa muncul?
caranya adalah dengan memberikan energi (radiasi elektromagnetik) yang besarnya sama dengan delta energi (delta E) sehingga spin yang searah dengan energi dari medan magnet eksternal mengabsorbsi energi yang diberikan, akibatnya spin berubah orientasinya, yakni berlawanan arah dengan medan magnet eksternal. Jadi berapa besar gelombang elektromagnetik yang diberikan??jawabannya adalah tergantung Bo nya.
Besarnya energi yang diberikan = Delta E
h.v = Delta E
h.v = h .gama .Bo/ 2 phi
v = gama .Bo/ 2 phi
v disebut frekuensi resonansi yang besarnya sebanding dengan gama (magnetic gerik) dan medan magnet eksternal yang diberikan.
Berikut adalah Kekuatan medan magnet eksternal, Bo beserta harga frekuensi agar inti tertentu dapat beresonansi
| Isotope | Bo (Gauss) | n (MHz) |
| 1H | 10.000 14.100 21.150 23.500 51.480 | 42,6 60,0 90,0 100,0 220,0 |
| 2H | 10.000 | 6,5 |
| 13C | 10.000 21.150 | 10,7 22,6 |
| 19F | 10.000 | 40,0 |
| 35Cl | 10.000 | 4,2 |
|
|
semakin tebal elektron yang mengelilingi suatu atom, maka akan merasakan semakin kecil medan magnet eksternal.
Lantas, pertanyaan selanjutnya , bagaimana cara memperoleh spektrum NMR?
Ada 2 teknik untuk memperoleh spectra NMR. Yaitu:
1. Continous Wave (CW). Pada CW, proton – proton di eksitasikan satu persatu. dibagi menjadi field –swab dan frequency swab. field swab adalah Bo divariasi, dan v tetap. sedangkan frequency swab sebaliknya.
2. Pulse Fourier Transform (PFT atau FT) – proton dieksitasi serempak, diberi energi radiasi yang mencakup semua eksitasi. sehingga signal sampel akan naik terus naik terus, dengan demikian ratio signal to noise akan tinggi, signal meningkat terus dan noise tidak terlihat.
Kelebihan teknik FT disbanding CW adalah:
- Lebih cepat
- Lebih sensitif (karena 'ratio signal to noise' ditingkatkan).
Inti di kelilingi oleh elektron yang tentunya bermuatan. Apabila diberi medan Bo,maka elektron ini akan menimbulkan medan magnet juga, yang disebut medan magnet lokal. Medan magnet lokal ini arahnya kemana? melawan medan magnet yang diberikan. Misalnya saja jika Bo diberi 100 teslon dan medan magnet lokalnya 20 teslon. maka medan magnet yang dirasakan oleh inti tidak 100 teslon melainkan 80 teslon (100-20).
Nah…padahal density elektron setiap atom pada satu molekul itu berbeda – beda (hanyo kenapa??). sehingga semakin density elektronnya pada atom yang berada pada satu molukul bernilai tinggi, maka menyebabkan medan magnet eksternal (Bo ) yang dirasakan oleh inti atom yang berada pada satu molekul juga semakin kecil karena terjadi pengurangan oleh medan magnet lokal. Apabila boleh diasumsikan, maka medan magnet eksternal adalah angin, sedangkan medan magnet lokal adalah jaket yang ada dalam tubuh kita. semakin tebal jaket, kita akan semakin sedikit merasakan angin.
B effektif = Bo - Blokal
dengan demikian, menyebabkan frekuensi resonansi (v) masing masing atom berbeda – beda, karena v berbanding lurus dengan Bo.
v = (gama/2 phi)* Bo
dengan demikian, akan muncul dua istilah :
Inti yang beresonansi dengan frekuensi tinggi akibat Blokal yang melawan B eksternal tenaganya kecil. Blokal kecil disebabkan karena density elektron yang rendah sehingga atom tidak terlindungi. Akibatnya atom merasakan Beffektif yang tinggi. Karena jaketnya kecil (dilindungi elektron yang rendah) maka disebut dishielding.
dan Inti yang beresonansi dengan frekuensi kecil akibat Blokal yang melawan B eksternal tenaganya besar. Blokal besar disebabkan karena density elektorn yang tinggi sehingga atom terlindungi dari Beksternal, dengan demikian Beffektifk yang dirasakan oleh atom adalah kecil, sehingga daerahnya sering disebut shielding. Karena B effektif kecil, maka vrekuensinya juga kecil, sehingga sering disebut juga pada daerah tersebut lower frekuensi.
TMS merupakan senyawa yang dianggap sebagai molekul yang protonnya paling terlindungi karena density elektronnya tinggi. AKibatnya atom proton merasakan Beffektif paling rendah diantara atom –ataom proton/carbon senyawa – senyawa lainnya. Oleh karena itu TMS sering digunakan sebagai penanda nilai vrekuensi 0. B effektif besar, maka vrekuensi besar, sehingga daerahnya sering disebut hight frekuensi.
Kenapa digunakan TMS??
Dalam suatu molekul, tiap proton berada dalam lingkungan kimia yang sedikit berbeda, sehingga ia akan mempunyai shielding elektronik yang tingkatannya sedikit berbeda. Perbedaan frekuensi resonansi proton-proton tersebut sangat kecil.
Misalnya: Dalam medan magnet eksternal 14.100 Gauss, perbedaan frekuensi resonansi proton dalam CH3Cl dan CH3F hanya sebesar 72 Hz. Sedangkan frekuensi yang diperlukan untuk beresonansinya proton dalam medan magnet tersebut adalah 60 MHz (60.000.000 Hz). Bila dibandingkan dengan ini, maka perbedaan frekuensi kedua macam proton tersebut di atas hanyalah sangat kecil, yaitu sekitar 1 ppm saja (72/60.000.000 = 1,2 x 10-6).
Sangat sulit mengukur frekuensi absolut dari masing-masing proton yang berbeda tersebut.
Untuk itu, dalam NMR yang diukur adalah perbedaan frekuensi antara suatu jenis proton dengan frekuensi resonansinya proton senyawa reference. Senyawa ini disebut sebagai standard internal dan ditambahkan ke dalam sample sebelum me'running' NMR.
Senyawa yang digunakan sebagai senyawa reference tersebut adalah:
Tetrametilsilan (TMS)
=TMS memberikan signal yang tajam (singlet) dengan intensitas tinggi, karena mempunyai 12 proton yang ekivalen.
=Mengabsorbsi pada 'higher field' dibanding hampir semua proton organik. (Si bersifat elektropositif, sehingga proton-proton dalam TMS sangat terlindungi (shielded))
n turun (d = 0).
=Bersifat inert.
=Mempunyai titik didih yang rendah (27oC), sehingga mudah dihilangkan kalau dikehendaki lagi senyawa yang diuji.
=Larut dalam kebanyakan pelarut organik.
TMS tidak larut dalam air maupun D2O. Dalam hal ini TMS dapat dilakukan sebagai 'eksternal standard'. Atau dapat juga dipakai garam Natrium dari asam 3-(trimetilsilil)-propanasulfonat.
(CH3)3SiCH2CH2CH2SO3-Na+
Berapa Hz bergesernya suatu proton dari TMS akan tergantung pada kekuatan medan magnet eksternal yang digunakan.Semakin besar medan magnet yang digunakan, semakin besar perbedaan frekuensi dari TMS.
Sumber : semuanya di catat dari perkuliahan S1 dan S2 Fakultas Farmasi UGM Elusidasi struktur Dr. Ratna Asmah S., M.Si,







![clip_image002[1] clip_image002[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgh-BFBIiIXwwZayB2c9Y-hHFh5gK7o12YdtLaiIkolCZzp3lW-qZE4EjH3ZZKoT2H3oizHjuFDgoLdWcTH2ap3GuqBv-mJIO6Tv9K-C7-BbtUw8Q05MOUrKhTal1OwpfkFuzOFp6YcdXET/?imgmax=800)
![clip_image002[3] clip_image002[3]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEi0ujUkE4ZTBQLj-kLuqJS8IAwic0YEIrB-BMLmTCgGJlyarj44lrEBF3z4sdTcV1dMWEd0-0PRZbuO0bJKYSyhayu84s747hSNKI1ulCsR6Jx0Qx9euUjQieJ3LTjpWeoL_7OcEXHeoEmB/?imgmax=800)
![clip_image002[1] clip_image002[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjE1GrByauGODtrCRGHezuASTuRjsTPY7_RtZCMdkFm7-AvTXUshSkOU4KFGgEjaFWAJYHeXdMRQGMRcGHesQlY86C8p_3KVlK3GKpVuw-kb_lAt81yMaEHpiDf8y8Pr-KmKQGlwI11boGy/?imgmax=800)

1 komentar:
Keren... Syukran,,
Posting Komentar
komentari dunk....(tapi maaf ya...karena banyak spam yang masuk, maka saya harus terpaksa memunculkan verifikasi kata)